题目内容
【题目】某小组将反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计为如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为2molL﹣1 , 溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.下列说法中错误的是( ) 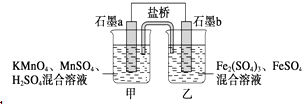
A.电池工作时,盐桥中的SO42﹣移向乙烧杯
B.石墨b的电极反应式为Fe2+﹣e﹣═Fe3+
C.当有0.1 mol SO42﹣进入烧杯时,反应消耗H+0.2 mol
D.当 MnSO4浓度变为2.2 molL﹣1时,反应中转移电子0.2 mol(不考虑溶液的体积变化)
【答案】C
【解析】解:A、原电池中阴离子影响负极,b为负极,所以盐桥中的SO42﹣移向乙烧杯,故A正确;
B、Fe元素的化合价升高,失去电子,电极反应式为Fe2+﹣e﹣═Fe3+ , 故B正确;
C、当有0.1 mol SO42﹣进入烧杯时,转移0.2mol电子,据2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O可知,每转移10mol电子有16mol氢离子消耗,所以转移0.2mol电子,消耗氢离子为3.2mol,故C错误;
D、每生成1molMnSO4转移电子5mol,MnSO4浓度变为2.2 molL﹣1时,生成MnSO40.04mol,转移电子0.2mol,故D正确;
故选C.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目