题目内容
8.下列各组数据中,前者一定比后者大的是( )| A. | 相同温度下,pH=10的KOH溶液和pH=10的K2CO3溶液由水电离出的OH-浓度 | |
| B. | 0.1 mol•L-1(NH4)2SO4溶液与0.1 mol•L-1(NH4)2CO3溶液中NH4+浓度 | |
| C. | Na2CO3溶液中HCO3-和OH-的浓度 | |
| D. | 纯水在80℃和在常温下的pH |
分析 A.碱抑制水的电离,能水解的盐促进水的电离;
B.铵根离子和碳酸根离子发生相互促进的水解反应;
C.Na2CO3溶液中碳酸根离子水解生成HCO3-和OH-;
D.纯水时,温度越高pH越小.
解答 解:A.KOH抑制水的电离,K2CO3促进水的电离,所以相同温度下,pH=10的KOH溶液和pH=10的K2CO3溶液由水电离出的OH-浓度,后者大,故A错误;
B.铵根离子和碳酸根离子发生相互促进的水解反应,(NH4)2CO3溶液中NH4+的水解程度大于(NH4)2SO4溶液NH4+的水解程度,水解程度越大,NH4+浓度越小,所以0.1 mol•L-1(NH4)2SO4溶液与0.1 mol•L-1(NH4)2CO3溶液中NH4+浓度,前者一定比后者大,故B正确;
C.Na2CO3溶液中碳酸根离子水解生成HCO3-和OH-,水也电离出OH-,所以OH-的浓度大于HCO3-,故C错误;
D.纯水时,温度越高水的电离程度越大,氢离子浓度越大,pH越小,所以纯水在80℃和在常温下的pH,前者小,故D错误.
故选B.
点评 本题考查盐类水解、水的电离、pH的判断等,明确盐类水解的规律、pH与浓度的关系等知识即可解答,题目难度不大,侧重于考查学生的分析能力和应用能力.

练习册系列答案
相关题目
6.下列说法中,正确的是( )
| A. | 淀粉和纤维素互为同分异构体 | |
| B. | 苯和甲苯可用酸性KMnO4溶液鉴别 | |
| C. | 按系统命名法,化合物 ,名称为:2,4-二甲基-5-丙基庚烷 ,名称为:2,4-二甲基-5-丙基庚烷 | |
| D. | 若两种二肽互为同分异构体,则二者的水解产物一定不相同 |
7.锶有“金属味精”之称.以天青石(主要含有SrSO4和少量CaCO3、MgO杂质)生产氢氧化锶的工艺如图:
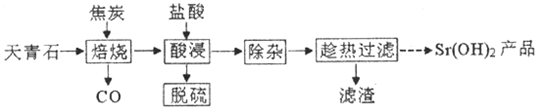
已知氢氧化锶在水中的溶解度:
(1)若隔绝空气焙烧时SrSO4只被还原成SrS,写出焙烧时的化学反应方程式SrSO4+4C$\frac{\underline{\;高温\;}}{\;}$SrS+4CO↑
(2)“除杂”方法:将溶液升温至95℃,加NaoH溶液调节pH为12.
①95℃时水的离子积Kw=1.0×10-12,Ksp[mg (OH)2]=1.2×10-10则溶液中c(Mg2+)=1.2×10-10mol•L-1
②若PH过大,将导致氢氧化锶的产率降低,请解释原因OH-对氢氧化锶的溶解起抑制作用,OH-浓度过大,将使氢氧化锶沉淀析出
(3)‘趁热过滤”的目的是防止温度降低使氢氧化锶析出而造成损失,“滤渣”的主要成分为Ca(OH)2、Mg(OH)2
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为降温结晶、过滤、洗涤、干燥.
(5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,吸收时发生反应的化学方程式为2FeCl3+H2S=2FeCl2+S↓+2HCl.

已知氢氧化锶在水中的溶解度:
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
| 溶液度(g/100ml) | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(2)“除杂”方法:将溶液升温至95℃,加NaoH溶液调节pH为12.
①95℃时水的离子积Kw=1.0×10-12,Ksp[mg (OH)2]=1.2×10-10则溶液中c(Mg2+)=1.2×10-10mol•L-1
②若PH过大,将导致氢氧化锶的产率降低,请解释原因OH-对氢氧化锶的溶解起抑制作用,OH-浓度过大,将使氢氧化锶沉淀析出
(3)‘趁热过滤”的目的是防止温度降低使氢氧化锶析出而造成损失,“滤渣”的主要成分为Ca(OH)2、Mg(OH)2
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为降温结晶、过滤、洗涤、干燥.
(5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,吸收时发生反应的化学方程式为2FeCl3+H2S=2FeCl2+S↓+2HCl.
3.设NA为阿伏加德罗常数,下列有关叙述不正确的是( )
| A. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为($\frac{7}{22.4}$)NA | |
| B. | 1 mol甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.5 mol 1,3-丁二烯分子中含有π键数为NA | |
| D. | 1 mol乙酸所含的电子总数为32NA |
13.NA为阿伏伽德罗常数,下列叙述正确的是( )
| A. | 室温下,lLpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| B. | 标准状况下,2.24LCl2通入水中充分反应,转移电子数目0.1NA | |
| C. | 常温常压下,42g乙烯和丁烯混合气体中,含原子数目为9NA | |
| D. | 氢氧燃料电池正极消耗22.4L (标准状况)气体时,电路中通过的电子数目为2NA |
17.已知反应A(g)+B(g)═C(g)+D(s)的能量变化如图所示,下列说法正确的是( )


| A. | 该反应的能量变化表现为释放能量 | |
| B. | 该反应中反应物A、B的总能量小于生成物C 的能量 | |
| C. | 该反应的能量变化是将化学能转化为热能、电能等其它形式 | |
| D. | 该反应能量变化的实质是旧化学键断裂和新化学键形成的结果 |
18.下列关于有机物的说法正确的是( )
| A. | 石油的催化重整、煤的干馏均可以得到芳香烃 | |
| B. | 乙酸、草酸均不能使酸性高锰酸钾溶液褪色 | |
| C. | 新戊烷的所有碳原子位于同一平面 | |
| D. | 奶油、鸡蛋清均属于高分子化合物且均能发生水解反应 |