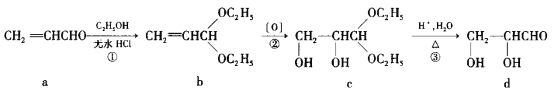
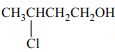题目内容
【题目】某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应)。请回答下列问题:
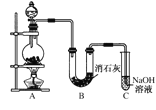
(1)A为实验室制氯气的发生装置,反应化学方程式为_________________________;某学生用12 mol·L-1的浓盐酸100 mL和足量的MnO2反应制Cl2,实际得到的Cl2________6.72 L(填“<”、“>”或“=”)。
(2)漂白粉将在U形管中产生,其化学方程式是_________________________________。
(3)此实验所得漂白粉的有效成分偏低。该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是________________。
②Cl2中含HCl,会发生反应2HCl+Ca(OH)2===CaCl2+2H2O,为避免此副反应的发生,可将装置作何改进______________________________。
(4) C装置的作用是________________________________。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O < 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O 冷却B装置(或将B装置放在冷水浴中) 在A与B之间连接一个装有饱和氯化钠溶液的洗气瓶 吸收未反应完的氯气,防止污染空气
MnCl2+Cl2↑+2H2O < 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O 冷却B装置(或将B装置放在冷水浴中) 在A与B之间连接一个装有饱和氯化钠溶液的洗气瓶 吸收未反应完的氯气,防止污染空气
【解析】
装置A制备氯气,氯气在与消石灰发生反应得到次氯酸钙,氯气有毒,用碱液吸收。
(1)实验室制氯气的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;二氧化锰和稀盐酸不反应,随着反应的进行,盐酸浓度变稀,用12 mol·L-1的浓盐酸100 mL和足量的MnO2反应制Cl2,实际得到的Cl2<6.72 L;
MnCl2+Cl2↑+2H2O;二氧化锰和稀盐酸不反应,随着反应的进行,盐酸浓度变稀,用12 mol·L-1的浓盐酸100 mL和足量的MnO2反应制Cl2,实际得到的Cl2<6.72 L;
(2)氢氧化钙与氯气反应的化学方程式是2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O;
(3)①氯气与氢氧化钙反应放热反应,温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是降低温度,将B装置放在冷水浴中;
②Cl2中含HCl,会发生反应2HCl+Ca(OH)2===CaCl2+2H2O,为避免此副反应的发生,先除去氯气中的氯化氢,可在A与B之间连接一个装有饱和氯化钠溶液的洗气瓶;
(4)氯气有毒,C装置的作用是吸收未反应完的氯气,防止污染空气。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】TK时,向2.0 L恒容密闭容器中充入0.10 mol COCl2,发生反应COCl2(g)![]() Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.030 | 0.039 | 0.040 | 0.040 |
下列说法正确的是
A. 保持其他条件不变,升高温度,平衡时c(Cl2)=0.022 mol·L-1,则反应的ΔH<0
B. 反应在前2 s的平均速率v(CO)=0.015 mol·L-1·s-1
C. 保持其他条件不变,起始向容器中充入0.12 mol COCl2、0.06 mol Cl2和0.06 mol CO,反应达到平衡前的速率:v正<v逆
D. 保持其他条件不变,起始向容器中充入0.10 mol Cl2和0.08 mol CO,达到平衡时,Cl2的转化率小于60%