题目内容
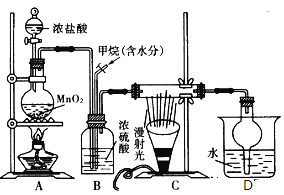
【题目】如图是模拟侯氏制碱法的部分装置。下列操作正确的是![]()
![]()
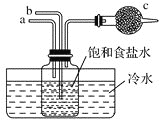
A.b通入![]() ,然后a通入
,然后a通入![]() ,c中放碱石灰
,c中放碱石灰
B.a通入![]() ,然后b通入
,然后b通入![]() ,广口瓶中析出
,广口瓶中析出![]()
C.a通入![]() ,然后b通入
,然后b通入![]() ,c中放蘸稀硫酸的脱脂棉
,c中放蘸稀硫酸的脱脂棉
D.b通入![]() ,然后a通入
,然后a通入![]() ,c中放蘸NaOH溶液的脱脂棉
,c中放蘸NaOH溶液的脱脂棉
【答案】C
【解析】
“侯氏制碱法”制取![]() 的原理是在饱和食盐水中通入氨气和二氧化碳,而得到
的原理是在饱和食盐水中通入氨气和二氧化碳,而得到![]() ,在这一实验过程中,由于
,在这一实验过程中,由于![]() 在水中的溶解度较小,而
在水中的溶解度较小,而![]() 的溶解度较大,为防止倒吸,b管通
的溶解度较大,为防止倒吸,b管通![]() ,a管通
,a管通![]() ,所以要在食盐水先通
,所以要在食盐水先通![]() 然后再通
然后再通![]() ,否则
,否则![]() 通入后会从水中逸出,等再通
通入后会从水中逸出,等再通![]() 时溶液中
时溶液中![]() 的量就很少了,这样得到的产品也很少;在这个实验中的尾气主要是
的量就很少了,这样得到的产品也很少;在这个实验中的尾气主要是![]() 和
和![]() ,其中
,其中![]() 对环境影响较大,要吸收,而
对环境影响较大,要吸收,而![]() 是碱性气体,所以在C装置中要装酸性物质,
是碱性气体,所以在C装置中要装酸性物质,
A、C装置中要装酸性物质,故A错误;
B、广口瓶中析出的是NaHCO3,故B错误;
C、 a通入![]() ,然后b通入
,然后b通入![]() ,c中放蘸稀硫酸的脱脂棉,吸收NH3 ,故C正确;
,c中放蘸稀硫酸的脱脂棉,吸收NH3 ,故C正确;
D、c中放蘸稀硫酸的脱脂棉,故D错误,
故选C。

 阅读快车系列答案
阅读快车系列答案【题目】反应①Fe(s)+CO2(g)=FeO(s)+CO(g);△H1=akJmol-1
反应②CO(g)+![]() O2(g)=CO2(g);△H2=bkJmol-1
O2(g)=CO2(g);△H2=bkJmol-1
测得在不同温度下,在密闭容器中进行的反应①的平衡常数K值随温度的变化如下:
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.46 | 2.51 |
(1)反应①的化学平衡常数表达式为___,a___0(填“>”、“<”或“=”)。在500℃2L密闭容器中进行反应①,Fe和CO2的起始物质的量均为4mol,10min后达到平衡状态,平衡时CO2的转化率为___,用CO表示的化学反应速率为___。
(2)700℃反应①到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有___(填序号)。
A.缩小反应容器体积
B.通入CO2
C.升高温度到900℃
D.使用合适的催化剂
(3)由反应①和②可求得反应2Fe(s)+O2(g)=2FeO(s)△H3中的△H3=___(用含a、b的代数式表示)。