题目内容
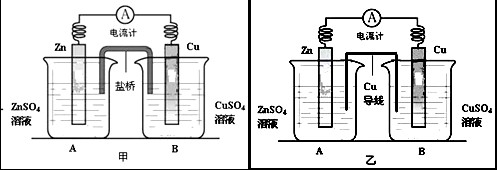
(14分)Ⅰ、某化学活动小组利用如下甲装置对原电池进行研究,请回答下列问题:(其中盐桥为含有饱和KCl溶液的琼脂)
(1)在甲图装置中,当电流计中指针发生偏转时,盐桥中的离子移动方向为:K+移向_____烧杯,Cl-移向______烧杯(填“A”或“B”),装置中电子的移动路径和方向为___________________________。
Ⅱ、该小组同学提出设想:如果将实验中的盐桥换为导线(铜制),电流表是否也发生偏转呢?带着疑问,该小组利用图乙装置进行了实验,发现电流计指针同样发生偏转。回答下列问题:
(2)该小组的一位成员认为溶液中的阴阳离子能通过铜导线从而构成闭合回路形成电流,该装置仍然为原电池。你对该观点的评价是__________(填“正确”或“不正确”)。
(3)对于实验中产生电流的原因,该小组进了深入探讨,后经老师提醒注意到使用的是铜导线,烧杯A实际为原电池。那么在烧杯B中铜片上发生反应的电极反应式为______________________。
(4)对于图乙烧杯A实际是原电池的问题上,该小组成员发生了很大分歧:
①一部分同学认为是由于ZnSO4溶液水解显酸性,此时原电池实际是由Zn、Cu做电极,H2SO4溶液作为电解质溶液而构成的原电池。如果这个观点正确,那么原电池的电极反应式为:
正极:_________________________________。
②另一部分同学认为是溶液酸性较弱,由于溶解在溶液中的氧气的作用,使得Zn、Cu之间形成原电池。如果这个观点正确,那么原电池的电极反应式为:
正极:_________________________________。
(5)若第(4)问中②观点正确,则可以利用此原理设计电池为在偏远海岛工作的灯塔供电。其具体装置为以金属铝和石墨为电极,以海水为电解质溶液,请写出该电池工作时总反应的化学方程式
____________________________________________________________________。
(1)B(1分) A(1分) 由Zn电极沿导线流向Cu电极 (2分,不答出电极和沿导线不给分) (2)不正确(2分) (3)Cu2+ + 2e- = Cu(2分)
(4)① 2H+ + 2e- = H2↑(2分)②O2+2H2O+4e-=4OH-(2分)
(5)4Al + 3O2 + 6H2O = 4Al(OH)3(2分)
【解析】

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案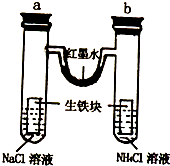 某化学活动小组利用如图探究金属腐蚀原理,将装置放置一段时间,下列有关叙述错误的是( )
某化学活动小组利用如图探究金属腐蚀原理,将装置放置一段时间,下列有关叙述错误的是( )| A、生铁块中的碳是原电池的正极 | B、红墨水柱两边液左高右低 | C、a、b中生铁均发生电化腐蚀 | D、a管中溶液pH升高,b管中pH降低 |
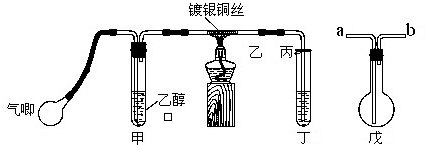
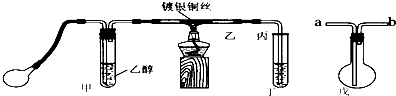 某课外活动小组利用如图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置己略去,粗黑线表示乳胶管.请填写下列空白:
某课外活动小组利用如图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置己略去,粗黑线表示乳胶管.请填写下列空白: