��Ŀ����
����Ŀ��T��ʱ��A������B���巴Ӧ����C���壬��Ӧ������A��B��CŨ�ȱ仯��ͼ������ʾ�������������������䣬�¶ȷֱ�ΪT1��T2ʱ��B�����������ʱ��Ĺ�ϵ��ͼ������ʾ�� 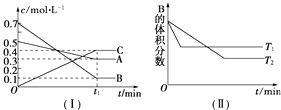
���������������ش��������⣺
��1��A��B��Ӧ����C�Ļ�ѧ����ʽΪ �� ����ӦΪ������ȡ����ȡ�����Ӧ��
��2�����ܱ������У�����2mol A��6mol B��
�ٵ���Ӧ�ﵽƽ��ʱ��A��B��Ũ�ȱ�����A��B��ת����֮���� ��
������ƽ����ϵ���¶ȣ�����������䣩����������ƽ����Է������� �� ����������С�����䡱��
�۵��ﵽƽ��ʱ�����������������ѹǿ���䣬ƽ�⽫������������������ƶ���
���𰸡�
��1��A��g��+3B��g��?2C��g��������
��2��1��3��7��15����������
���������⣺��1����ͼ����֪��A��B�����ʵ���Ũ�ȼ�С��C�����ʵ���Ũ�����ӣ���A��BΪ��Ӧ�CΪ������ɷ�Ӧ��Ũ�ȵı仯֮�ȵ��ڻ�ѧ������֮�ȿɵã���c��A������c��B������c��C��=0.2mol/L��0.6mol/L��0.4mol/L=1��3��2����Ӧ�Ļ�ѧ����ʽΪ��A��g��+3B��g��2C��g������ͼ����֪T1��T2 �� �����¶�B�������������˵�������¶�ƽ�����淴Ӧ�����ƶ�������ӦΪ���ȷ�Ӧ��
���Դ��ǣ�A��g��+3B��g��2C��g�������ȣ�
��2.���ٸ������������㣬
A��g�� | + | 3B��g�� | 2C��g�� | ||
��ʼmol/L | 0.5 | 0.7 | 0 | ||
�仯mol/L | 0.2 | 0.6 | 0.4 | ||
ƽ��mol/L | 0.3 | 0.1 | 0.4 |
����Ӧ�ﵽƽ��ʱ��A��B��Ũ�ȱ���3��1��A��ת����= ![]() ��B��ת����=
��B��ת����= ![]() ��A��B��ת����֮����7��15�����Դ��ǣ�7��15��
��A��B��ת����֮����7��15�����Դ��ǣ�7��15��
�ڸ÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���������������䣬���ʵ������ƽ����Է���������С�����Դ��ǣ���С��
��ѹǿ���䣬���������������ѹ��С��ƽ���������������ķ����ƶ������������ƶ������Դ��ǣ�����
�����㾫����������Ҫ���������ȷ�Ӧ�ͷ��ȷ�Ӧ�ͻ�ѧƽ��״̬���ʼ����������֪ʶ�㣬��Ҫ���ջ�ѧ�ϰ����������Ļ�ѧ��Ӧ��Ϊ���ȷ�Ӧ����ѧ�ϰѷų������Ļ�ѧ��Ӧ��Ϊ���ȷ�Ӧ����ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч��������ȷ�����⣮

 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д� ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д�����Ŀ��ʵ�����Ʊ�1��2����������ķ�Ӧԭ�����£� CH3CH2OH��CH2=CH2
CH2=CH2+B2��BrCH2CH2Br
���ܴ��ڵ���Ҫ����Ӧ�У��Ҵ���Ũ����Ĵ�������l40����ˮ�������ѣ�
������������������Ҵ��Ʊ�1��2�����������װ������ͼ��ʾ
�й������б����£�
�Ҵ� | 1��2���������� | ���� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶ�/gcm��3 | 0.79 | 2.2 | 0.71 |
�е�/�� | 78.5 | 132 | 34.6 |
�۵�/�� | ��130 | 9 | ��116 |
�ش��������⣺
��1���ڴ��Ƹ�ʵ���У�Ҫ������Ѹ�ٵذѷ�Ӧ�¶���ߵ�170�����ң�������ҪĿ������������ȷѡ��ǰ����ĸ�� a��������Ӧ b���ӿ췴Ӧ�ٶ� c����ֹ�Ҵ��ӷ� d�����ٸ�������������
��2����װ��C��Ӧ���� �� ��Ŀ�������շ�Ӧ�п������ɵ��������壺������ȷѡ��ǰ����ĸ�� a��ˮ b��Ũ���� c������������Һ d������̼��������Һ
��3���жϸ��Ƹ���Ӧ�Ѿ����������������
��4����1��2����������ֲ�Ʒ���ڷ�Һ©���м�ˮ�����ã�����Ӧ���㣨��ϡ������¡�����
��5����������������δ��Ӧ��Br2 �� �����ϴ�ӳ�ȥ��������ȷѡ��ǰ����ĸ�� a��ˮ b������������Һ c���⻯����Һ d���Ҵ�
��6�������������������������ѣ������ķ�����ȥ��
��7����Ӧ������Ӧ����ˮ��ȴװ��D������ҪĿ���������ֲ��ܹ�����ȴ�����ñ�ˮ������ԭ���� ��
����Ŀ��X��Y��R��ZΪ���ֶ�����Ԫ�أ���Ԫ�����ڱ��е�λ����ͼ��ʾ����֪RԪ�ص���������������������������˵����ȷ����( )
X | Y | |||
R | Z |
A.����Ԫ�ص�ԭ���У�Yԭ�ӵİ뾶���
B.Y��X��ɵĻ���������ˮ������
C.���R��Z��ɵĻ������Ʊ�R����
D.Һ̬Z���ʿ��Ա����ڸ�ƿ��

