题目内容
【题目】在体积为2L的恒容密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)反应在三种不同的条件下进行,反应物SO2的物质的量(mol)随反应时间(min)的变化情况如下表所示:
2SO3(g)反应在三种不同的条件下进行,反应物SO2的物质的量(mol)随反应时间(min)的变化情况如下表所示:

(1)对照实验1,实验2改变的某一外界条件可能是_______。
(2)反应达平衡后,向实验2中加入少量的18O2,一段时间18O后可能存在于哪些物质中________(填选项)。
A 只存在氧气 B 只存在三氧化硫 C 只存在反应物 D 存在反应物与生成物
(3)实验3中,在5~15min时段,用O2表示的平均反应速率为______ mol/(L·min)。
(4)若将实验1置于绝热体系中,测得实验到达平衡的时间比原来缩短了,则参加反应的SO2和O2的总能量______(填“>”、“<”或“=”)生成的SO3的总能量。
(5)能说明实验3达到平衡状态的标志是_______(任写一条)。
【答案】加入催化剂 D 0.005 > 各物质的物质的量不再改变(或各物质的物质的量浓度不再改变等合理答案)
【解析】
(1)对照实验1,实验2的数据,起始时反应物SO2的物质的量相同,但实验2建立平衡需要的时间短,平衡时SO2的物质的量相同,结合影响化学反应速率的因素分析解答;
(2) 2SO2(g)+O2(g)![]() 2SO3(g)反应同时向正反应和逆反应方向进行,据此分析解答;
2SO3(g)反应同时向正反应和逆反应方向进行,据此分析解答;
(3)根据二氧化硫的变化量结合方程式计算出氧气的变化量,再根据v=![]() 计算;
计算;
(4)在绝热体系中气体的温度与反应的热效应有关,结合影响化学反应速率的因素分析解答;
(5)根据平衡状态的特征分析解答。
(1)对照实验1,实验2的数据,起始时反应物SO2的物质的量相同,但实验2建立平衡需要的时间短,平衡时SO2的物质的量相同,因此改变的某一外界条件可能是实验2加入了催化剂,故答案为:加入催化剂;
(2) 2SO2(g)+O2(g)![]() 2SO3(g)反应达平衡后,向实验2中加入少量的18O2,一段时间18O会出现在二氧化硫、氧气和三氧化硫三种物质中,故选D;
2SO3(g)反应达平衡后,向实验2中加入少量的18O2,一段时间18O会出现在二氧化硫、氧气和三氧化硫三种物质中,故选D;
(3)实验3中,在5~15min时段,二氧化硫的物质的量的变化量为0.2mol,则氧气的物质的量变化量为0.1mol,用O2表示的平均反应速率为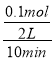 =0.005mol/(L·min),故答案为:0.005;
=0.005mol/(L·min),故答案为:0.005;
(4)若将实验1置于绝热体系中,测得实验到达平衡的时间比原来缩短了,说明反应速率加快,是因为反应放热,使得容器内气体的温度升高,因此参加反应的SO2和O2的总能量大于生成的SO3的总能量,故答案为:>;
(5)根据平衡状态的特征,能说明实验3达到平衡状态的标志有:各物质的物质的量不再改变、各物质的浓度不再改变、气体的压强不再改变等,故答案为:各物质的物质的量不再改变(或各物质的物质的量浓度不再改变等)。