题目内容
(1)下列物质:①CO2 ②盐酸 ③烧碱晶体 ④酒精 ⑤铁 ⑥纯醋酸(用编号回答)其中能导电的是______,属于电解质的有______;属非电解质的是______.
(2)0.270kg质量分数为10%的CuCl2溶液中CuCl2的物质的量______,(带单位)溶液中Cu2+和Cl-的物质的量分别为______,______.(带单位)
(3)标准状况下,224ml某气体的质量为0.32克,则该气体的相对分子质量______.
解:(1)①二氧化碳是化合物,分子不导电,二氧化碳溶于水,能电离出自由移动的氢离子和碳酸根离子,能导电,但这些离子不是它自身电离,故二氧化碳是非电解质;
②盐酸溶于水,能自身电离出自由移动的氢离子和氯离子,故盐酸能导电,它是混合物,它既不是电解质也不是非电解质;
③烧碱是氢氧化钠,氢氧化钠固体没有自由移动的离子,故不导电,在水溶液中能电离出自由移动的氢氧根离子和钠离子,能导电,是电解质;
④酒精是乙醇,是化合物,在水中存在乙醇分子,没有自由移动的离子,故不能导电,是非电解质;
⑤铁是金属,能导电,但它既不是电解质也不是非电解质;
⑥纯醋酸是纯净物,没有自由移动的离子,故不导电,但它的溶液能导电,故它是电解质;
故答案为:②⑤,③⑥,①④;
(2)该溶液中的CuCl2物质的量为n(CuCl2)=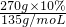 =0.2 mol;
=0.2 mol;
CuCl2 =Cu2++2Cl-
0.2 mol 0.2 mol 0.4 mol
故答案为:0.2 mol,0.2 mol,0.4 mol;
(3)根据质量和体积之间的关系公式m=n×M=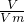 ×M可得,M=
×M可得,M=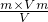 =
=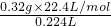 =32g/mol,
=32g/mol,
故答案为:32;
分析:(1)在水溶液中或熔化状态下,存在自由移动的带电微粒,就可导电;在水溶液中或熔化状态下能导电的化合物是电解质;在水溶液中和熔化状态下都不能导电的化合物是非电解质;单质和混合物既不是电解质,也不是非电解质;
(2)利用溶质的质量除以溶质的摩尔质量可得物质的量进行计算;
(3)根据质量和体积之间的关系公式m=n×M=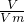 ×M计算;
×M计算;
点评:本题考查了电解质与非电解质、导电的本质、物质的量的有关计算,题目难度不大,计算时须注意把握有关计算公式的运用.
②盐酸溶于水,能自身电离出自由移动的氢离子和氯离子,故盐酸能导电,它是混合物,它既不是电解质也不是非电解质;
③烧碱是氢氧化钠,氢氧化钠固体没有自由移动的离子,故不导电,在水溶液中能电离出自由移动的氢氧根离子和钠离子,能导电,是电解质;
④酒精是乙醇,是化合物,在水中存在乙醇分子,没有自由移动的离子,故不能导电,是非电解质;
⑤铁是金属,能导电,但它既不是电解质也不是非电解质;
⑥纯醋酸是纯净物,没有自由移动的离子,故不导电,但它的溶液能导电,故它是电解质;
故答案为:②⑤,③⑥,①④;
(2)该溶液中的CuCl2物质的量为n(CuCl2)=
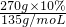 =0.2 mol;
=0.2 mol;CuCl2 =Cu2++2Cl-
0.2 mol 0.2 mol 0.4 mol
故答案为:0.2 mol,0.2 mol,0.4 mol;
(3)根据质量和体积之间的关系公式m=n×M=
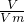 ×M可得,M=
×M可得,M=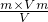 =
=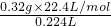 =32g/mol,
=32g/mol,故答案为:32;
分析:(1)在水溶液中或熔化状态下,存在自由移动的带电微粒,就可导电;在水溶液中或熔化状态下能导电的化合物是电解质;在水溶液中和熔化状态下都不能导电的化合物是非电解质;单质和混合物既不是电解质,也不是非电解质;
(2)利用溶质的质量除以溶质的摩尔质量可得物质的量进行计算;
(3)根据质量和体积之间的关系公式m=n×M=
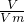 ×M计算;
×M计算;点评:本题考查了电解质与非电解质、导电的本质、物质的量的有关计算,题目难度不大,计算时须注意把握有关计算公式的运用.

练习册系列答案
相关题目





 Fe2+(aq)+3OH-(aq)
Fe2+(aq)+3OH-(aq) 利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.