题目内容
【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:

试回答下列问题:
(1)硫铁矿烧渣用稀硫酸酸溶时的不溶物为 (填化学式)。
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有 ;
步骤Ⅳ中应选用 试剂调节溶液的pH(填字母编号)。
A.稀硝酸 | B.氢氧化钠溶液 | C.高锰酸钾溶液 | D.氨水 |
(3)检验步骤Ⅲ已经进行完全的试剂是 。
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是 。
(5)步骤Ⅵ在空气中煅烧发生反应的化学反应方程式为 。
(6)欲测定硫铁矿烧渣中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg。
①写出加入足量的H2O2发生反应的离子反应方程式 ;
②测得该样品中Fe元素的质量分数为 。
【答案】(1)SiO2
(2)漏斗、玻璃棒、烧杯 D
(3)KSCN溶液(或其他合理答案)
(4)防止NH4HCO3分解,减少Fe2+的水解
(5)4FeCO3 + O2 ![]() 2Fe2O3 + 4CO2
2Fe2O3 + 4CO2
(6)①2Fe2++H2O2+2H+=2Fe3++2H2O ; ②7b/10a
【解析】试题分析:(1)硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)酸浸后过滤,SiO2与酸不反应,所以SiO2为滤渣,滤液中含有的金属阳离子是Fe2+、Fe3+。(2) “步骤Ⅱ”中分离操作是过滤,所用的玻璃仪器有漏斗、玻璃棒、烧杯;调节PH加入的试剂要与氢离子反应,同时不能引入新杂质,步骤Ⅳ中应选用氨水调节溶液的pH。
(2)步骤Ⅲ要把Fe3+还原为Fe2+,检验步骤Ⅲ已经进行完全,即溶液不含Fe3+,使用试剂是KSCN溶液;(4)NH4HCO3受热易分解,高温会促进Fe2+水解,所以步骤Ⅴ的反应温度一般需控制在35℃以下。
(5)步骤Ⅵ在空气中煅烧发生反应的化学反应方程式为4FeCO3 + O2 ![]() 2Fe2O3 + 4CO2。
2Fe2O3 + 4CO2。
(6)欲测定硫铁矿烧渣中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg。
①写出加入足量的H2O2发生反应的离子反应方程式2Fe2++H2O2+2H+=2Fe3++2H2O;
②产生沉淀,经过滤、洗涤、灼烧至固体恒重,得到的固体是Fe2O3,根据铁元素守恒,测得该样品中Fe元素的质量分数为![]() =7b/10a。
=7b/10a。

 期末冲刺100分创新金卷完全试卷系列答案
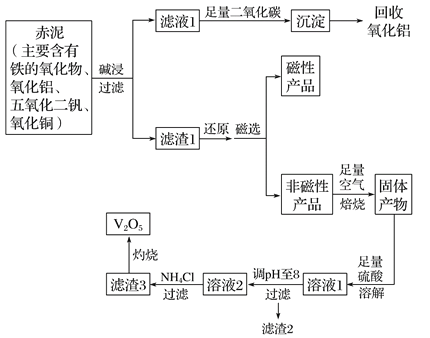
期末冲刺100分创新金卷完全试卷系列答案【题目】钒是一种熔点很高的金属,具有良好的可塑性和低温抗腐蚀性,有延展性、硬度大,无磁性。广泛应用于钢铁、航空航天、能源、化工等领域。中铝集团 (平果铝业公司)目前使用一种新型工艺,以便从铝业生成的固体废料——赤泥中提取金属钒,具体工艺流程图如下:
已知:
I.钒有多种价态,其中+5价最稳定。钒在溶液中主要以VO2+和VO3-的形式存在,存在平衡
VO2++H2O![]() VO3-+2H+。
VO3-+2H+。
Ⅱ.部分含钒物质在水中的溶解性如下表所示:
物质 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 难溶 | 难溶 | 易溶 |
Ⅲ.部分离子的沉淀pH值:
Cu2+ | Fe2+ | Fe3+ | |
开始沉淀pH值 | 5.2 | 7.6 | 2.7 |
完全沉淀pH值 | 6.4 | 9.6 | 3.7 |
请回答下列问题:
(1)碱浸步骤中最好选用 。
A.NaOH溶液 B.氨水 C.纯碱溶液
(2)写出滤液1与足量二氧化碳反应的离子方程式 。
(3)磁选步骤得到的磁性产品为 。
(4)溶液1到溶液2的过程中,调节pH值至8有两个目的,一是除去铜离子,二是使 。
(5)滤渣3的主要成分为 ,工业上常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式 。