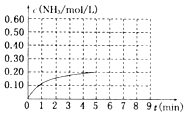
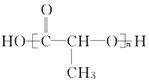
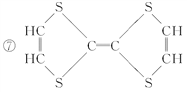
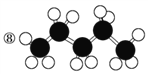
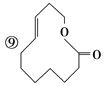
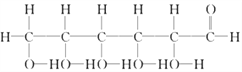
题目内容
【题目】FeCl3是一种用途比较广泛的盐。
(1)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,请写出反应的离子方程式____________________________.
(2)FeCl3在天然水中可生成氢氧化铁胶体,其沉降水中悬浮物的速度高于铝盐,是城市污水及工业废水处理的高效絮凝剂.实验室制取氢氧化铁胶体的方法是______(填字母序号)。
A.将饱和的FeCl3溶液滴入沸水中,生成棕黄色液体即可
B.在FeCl3溶液中加入足量的NaOH溶液
C.将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色液体
D.将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色沉淀
证明此胶体已经制成的最简单方法为______。
(3)FeCl3可使湿润的淀粉碘化钾试纸变蓝,化学方程式如下: FeCl3+ KI= FeCl2+ I2+ KCl,配平上述反应方程式,并在上式上用双线桥法标出该反应电子转移的方向和数目。________
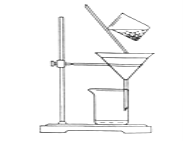
(4)向(3)反应后的溶液中加入CCl4溶液,振荡、静置后会发现_____层(填“上”或“下”)液体的颜色为______色,再将混合液倒入______(填仪器名称)中,将两层液体分离。
【答案】2Fe3++Cu=2Fe2++Cu2+ C 丁达尔效应 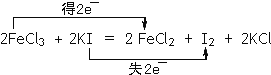 下 紫(或紫红) 分液漏斗
下 紫(或紫红) 分液漏斗
【解析】
(1)FeCl3溶液与铜反应生成氯化铜和氯化亚铁;(2)FeCl3在沸水中可生成胶体,胶体具有丁达尔效应;(3)根据化合价升降守恒配平方程式,反应中,Fe元素的化合价降低,I元素的化合价升高,以此分析电子转移;(4)向(3)反应后的溶液中加入CCl4溶液,发生萃取,四氯化碳的密度大于水。据此分析解答。
(1)FeCl3溶液作为“腐蚀液”腐蚀铜板,生成CuCl2和FeCl2,该离子反应为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)实验室制取氢氧化铁胶体的方法为将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色液体,则应选C,且胶体具有丁达尔效应,可利用此性质来证明此胶体已经制成,故答案为:C;丁达尔效应;
(3) FeCl3+ KI= FeCl2+ I2+ KCl中,Fe元素的化合价由+3价降低为+2价,I元素的化合价由-1价升高到0价,根据化合价升降守恒配平得:2FeCl3+2KI=2FeCl2+I2+2KCl电子转移的方向和数目可以表示为 ,故答案为:
,故答案为: ;
;
(4)向(3)反应后的溶液中加入CCl4溶液,发生萃取,有机层在下层,颜色为紫色(或紫红色),然后利用分液漏斗分离,故答案为:下;紫(或紫红);分液漏斗。

【题目】(1)某同学为探究酸性KMnO4溶液和H2C2O4(草酸,二元弱酸)溶液的反应过程,进行如下实验。请完成以下问题:
①写出酸性KMnO4溶液和H2C2O4的离子方程式___________________________________。
②配制100mL0.0400mol·L-1的H2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是_______________________________________。
③将KMnO4溶液逐滴滴入一定体积的酸性H2C2O4溶液中(温度相同,并振荡),记录的现象如下:
滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
先滴入第1滴 | 60s |
褪色后,再滴入第2滴 | 15s |
褪色后,再滴入第3滴 | 3s |
褪色后,再滴入第4滴 | 1s |
请分析KMnO4溶液褪色时间变化的可能原因___________________________________。
(2)![]() 和
和![]() 在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中
在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中![]() 随c(H+)的变化如图所示
随c(H+)的变化如图所示
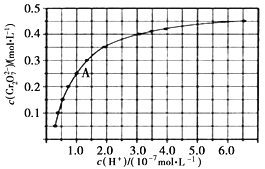
①用离子方程式表示溶液中![]() 和
和![]() 的转化反应_________。
的转化反应_________。
②由图可知,溶液酸性减小, ![]() 的平衡转化率_________(填“增大”“减小”或“不变”)。
的平衡转化率_________(填“增大”“减小”或“不变”)。
③升高温度,溶液中![]() 的平衡转化率减小,则该反应的ΔH_________0(填“大于”“小于”或“等于”)。
的平衡转化率减小,则该反应的ΔH_________0(填“大于”“小于”或“等于”)。