题目内容
下列各组反应(表内物质均为反应物)刚开始时,放出H2的速率最大的是
| 编号 | 金属(粉末状) | 酸的浓度 | 酸的体积 | 反应温度 |
| A | 0.1mol Mg | 6mol/L硝酸 | 10mL | 30℃ |
| B | 0.1mol Mg | 3mol/L盐酸 | 10mL | 60℃ |
| C | 0.1mol Fe | 3mol/L盐酸 | 10mL | 60℃ |
| D | 0.1mol Mg | 3mol/L盐酸 | 10mL | 30℃ |
B
解析试题分析:影响反应速率的根本原因是反应物对性质,镁比铁活泼,所以排除C;A、硝酸与镁反应不产生氢气,错误;B、D相比B的温度高,反应速率更快,所以放出H2的速率最大的是B组,答案选B。
考点:考查影响反应速率的因素及反应速率大小的判断

练习册系列答案
相关题目
下列措施不能增大反应速率的是
| A.锌与稀硫酸反应时,加少量铜粉 |
| B.Fe与稀硫酸反应制取H2时,改用98%浓硫酸 |
| C.Al在氧气中燃烧生成A12O3,将铝片改成铝粉 |
| D.恒温时,增大H2(g)+Br2(g) ?2HBr(g)反应体系的压强 |
对于①需加热才发生的反应、②放热反应、③熵增加的反应,可能属于自发反应的是
| A.只有② | B.只有③ | C.只有②③ | D.①②③ |
一定条件下,在体积为VL的密闭容器中,一氧化碳和氢气反应生成甲醇: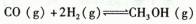
下图表示该反应在不同温度下的反应过程: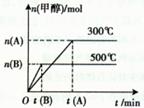
关于该反应,下列说法正确的是:( )
| A.反应达平衡后,升高温度,平衡常数K增大。 |
| B.反应过程中使用Cu2O/ZnO作催化剂,二者均不参加反应。 |
C.500℃反应达到平衡时,用氢气物质的量浓度减少表示该反应的反应速率是: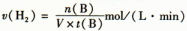 |
| D.300℃反应达到平衡后,若其他条件不变,将体积缩小到原来的1/2,平衡右移,氢气物质的量浓度增大。 |
在容积一定的密闭容器中,反应A(?)+B(g)  C(g)+D(g)达到平衡后,升高温度容器
C(g)+D(g)达到平衡后,升高温度容器
内气体的密度增大,则下列叙述正确的是( )
| A.正反应是放热反应 |
| B.A不是气态物质,加入A该平衡向正反应方向移动 |
| C.其他条件不变,加入A平衡不移动 |
| D.改变压强对该平衡的移动无影响 |
在一定温度下,在恒容的密闭容器中进行的可逆反应A(g)+3B(g) 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
| A.C生成的速率和C分解的速率相等 |
| B.单位时间内生成n mol A,同时生成3n mol B |
| C.B的消耗速率与C的消耗速率之比为1∶1 |
| D.混合气体密度保持不变 |
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
X2(g)+3Y2(g)  2XY3(g) ΔH=-92.6 kJ·mol-1
2XY3(g) ΔH=-92.6 kJ·mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 | 起始时各物质的物质的量/mol | 达到平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热:23.15 kJ |
| ② | 0.6 | 1.8 | 0.8 | Q(Q>0) |
下列叙述不正确的是( )
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量为Q
C.达到平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①的体积为0.20 L,则达平衡时放出的热量大于23.15 kJ
下列过程需要增大化学反应速率的是( )。
| A.钢铁腐蚀 | B.食物腐败 |
| C.塑料老化 | D.工业合成氨 |
为了进一步研究硫酸铜的量对氢气生成速率的影响,某同学设计了如表一系列实验。将表中所给的试剂按一定体积混合后,分别加入四个盛有过量Zn粒的反应瓶(甲、乙、丙、丁)中,收集产生的气体,记录收集相同体积的气体所需时间。
| 实验 试剂/mL | 甲 | 乙 | 丙 | 丁 |
| 4 mol/L H2SO4 | 20 | V1 | V2 | V3 |
| 饱和CuSO4溶液 | 0 | 2.5 | V4 | 10 |
| H2O | V5 | V6 | 8 | 0 |
下列说法正确的是 ( )
A.实验甲产生气泡的速率最快 B.V1<V2<V3<20
C.V4=V5=10 D.V6=7.5