题目内容
下列各原子或离子的电子排布式错误的是( )
| A.K+:1s22s22p63s23p6 | B.F:1s22s22p5 |
| C.S2—:1s22s22p63s23p4 | D.Ar:1s22s22p63s23p6 |
C
解析试题分析:原子核外电子排布应符合构造原理、能量最低原理、洪特规则和泡利不相容原理,结合原子或离子的核外电子数解答该题。A、K元素原子核外有19个电子,失去一个电子生成K+,K+的电子排布式为1s22s22p63s23p6,故A正确;B、F电子排布式为1s22s22p5,符合能量最低原理,故B正确;C、S2-电子排布式为1s22s22p63s23p6,故C不正确;D、Ar 电子排布式为1s22s22p63s23p6,符合能量最低原理,故D正确,答案选C。
考点:考查原子核外电子排布

练习册系列答案
相关题目
两种微粒含有相同的质子数和电子数,这两种微粒可能是
①两种不同的原子;②两种不同元素的原子;③一种原子和一种分子;④一种原子和一种离子;⑤两种不同分子;⑥一种分子和一种离子;⑦两种不同阳离子;⑧两种不同阴离子;⑨一种阴离子和一种阳离子
| A.①③⑤⑥⑦⑧ | B.①③⑤⑦⑧ |
| C.①③④⑤⑦ | D.全部都是 |
X、Y、Z、W、M均为短周期元素,X、Y同主族,X的氢化物和最高价氧化物的水化物能反应生成一种离子化合物,其水溶液显酸性;Z、W、M是第3周期连续的三种元素,其中只有一种是非金属,且原子半径Z>W>M。下列叙述准确的是
| A.X、M两元素氢化物的稳定性:X<M |
| B.Z、W、M的氧化物均可做耐高温材料 |
| C.Z是海水中含量最高的金属元素,W是地壳中含量最多的金属元素 |
| D.Z、W、M的单质均能与稀硫酸反应制取氢气,但反应剧烈程度依次减弱 |
若aXm+与bYn-的核外电子排布相同,下列关系式正确的是
| A.b=a-n+m | B.b-n=a-m |
| C.离子半径Xm+<Yn- | D.原子半径X<Y |
下列说法正确的是
| A.14C和14N质量数相同,互为同位素 |
| B.12C和14N含有相同的中子数 |
| C.12C和 13N中子数相同,质子数不同,互为同位素 |
| D.12CO和14CO物理性质不同,化学性质基本相同 |
某元素原子价电子构型3d54s2,其应在( )
| A.第四周期ⅡA族 | B.第四周期ⅡB族 |
| C.第四周期ⅦA族 | D.第四周期ⅦB族 |
下列说法中正确的是( )
| A.只含有一种元素的物质一定是纯净物 |
| B.石墨转变为金刚石为化学变化 |
| C.水很稳定是因为水分子间存在较强的分子间作用力 |
| D.相对分子质量相同的不同物质一定是同分异构体 |
下列各组物质互为同系物的是( )
| A.金刚石和石墨 | B.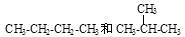 |
| C.CH4和C2H6 | D.16O和18O |
一容器中X元素构成的气态单质X2分子有3种,相对分子质量分别为32、34、36。又知容器中3种分子数之比为15∶4∶1。由此可以确定的是( )
| A.若容器中X2全部转化为它的同素异形体X3,那么X3的分子量有3种 |
| B.质量数为16的一种核素在此容器中的原子百分数为85% |
| C.只要容器中同位素组成不变,X原子在任何条件下发生重新组合,最后得到三种 X2,分子数之比总是15∶4∶1 |
| D.此容器中X2的平均分子量是34 |