题目内容
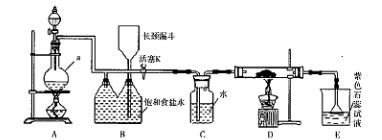
用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是
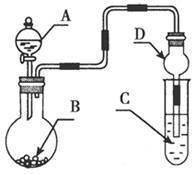

| A.若A为浓盐酸,B为KMnO4晶体,C中盛有紫色石蕊溶液,则C中溶液最终呈红色 |
| B.实验仪器D可以起到防止溶液倒吸的作用 |
| C.若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液先产生白色沉淀后沉淀又溶解 |
| D.若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊 |
B
A项,KMnO4和浓盐酸反应生成Cl2,Cl2通入紫色石蕊溶液中先变红后褪色;B项,仪器D体积较大,能防止生成的气体溶于水而引起倒吸;C项,左侧装置生成的NH3通入AlCl3溶液中生成白色沉淀Al(OH)3,其不溶于弱碱,即使通入过量NH3也不会溶解;D项,常温下Cu和浓硫酸不反应。

练习册系列答案
相关题目