题目内容
已知某二元酸(化学式用H2RO4表示)在水中的电离方程式为:H2RO4═H++HRO4-;HRO4-?H++RO42-.回答下列问题:
(1)NaHRO4溶液显 (填“酸性”、“中性”或“碱性”),理由是 (用离子方程式和必要的文字说明).
(2)Na2RO4溶液显 (填“酸性”、“中性”或“碱性”),理由是 (用离子方程式和必要的文字说明).
(3)如果25℃时,0.1mol/L的NaHRO4溶液中,c(RO42-)=0.029mol/L,则0.1mol/L H2RO4溶液中c(RO42-) 0.029mol/L(填“<”、“=”或“>”),理由是
(4)25℃时,0.1mol/L的NaHRO4溶液中,各离子浓度由大到小的顺序是 .
(1)NaHRO4溶液显
(2)Na2RO4溶液显
(3)如果25℃时,0.1mol/L的NaHRO4溶液中,c(RO42-)=0.029mol/L,则0.1mol/L H2RO4溶液中c(RO42-)
(4)25℃时,0.1mol/L的NaHRO4溶液中,各离子浓度由大到小的顺序是
分析:(1)由电离可知,NaHRO4溶液电离出氢离子;
(2)由HRO4-?H++RO42-可知,Na2RO4溶液水解显碱性;
(3)0.1mol/L的NaHRO4溶液中,c(RO42-)=0.029mol/L,0.1mol/L H2RO4溶液,第一步电离对HRO4-?H++RO42-起抑制作用;
(4)NaHRO4溶液中,HRO4-电离,则c(Na+)>c(HRO4-),且电离显酸性,结合水的电离等比较离子浓度大小.
(2)由HRO4-?H++RO42-可知,Na2RO4溶液水解显碱性;
(3)0.1mol/L的NaHRO4溶液中,c(RO42-)=0.029mol/L,0.1mol/L H2RO4溶液,第一步电离对HRO4-?H++RO42-起抑制作用;
(4)NaHRO4溶液中,HRO4-电离,则c(Na+)>c(HRO4-),且电离显酸性,结合水的电离等比较离子浓度大小.
解答:解:(1)由电离可知,NaHRO4溶液电离出氢离子,发生HRO4-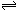 H++RO42-,且HRO4-不水解,溶液显酸性,故答案为:酸性;HRO4-
H++RO42-,且HRO4-不水解,溶液显酸性,故答案为:酸性;HRO4-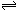 H++RO42-,且HRO4-不水解;
H++RO42-,且HRO4-不水解;
(2)由HRO4-?H++RO42-可知,Na2RO4溶液水解显碱性,水解离子反应为,故答案为:碱性;RO42-+H2O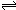 HRO4-+OH-;
HRO4-+OH-;
(3)0.1mol/L的NaHRO4溶液中,c(RO42-)=0.029mol/L,0.1mol/L H2RO4溶液,第一步电离对HRO4-?H++RO42-起抑制作用,所以c(RO42-)<0.029mol/L,
故答案为:<;H2RO4第一步电离产生的H+抑制了第二步电离;
(4)NaHRO4溶液中,HRO4-电离,则c(Na+)>c(HRO4-),且电离显酸性,水电离出氢离子,则c(H+)>c(RO42-)>c(OH-),所以离子浓度大小为c(Na+)>c(HRO4-)>c(H+)>c(RO42-)>c(OH-),故答案为:c(Na+)>c(HRO4-)>c(H+)>c(RO42-)>c(OH-).
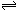 H++RO42-,且HRO4-不水解,溶液显酸性,故答案为:酸性;HRO4-
H++RO42-,且HRO4-不水解,溶液显酸性,故答案为:酸性;HRO4-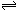 H++RO42-,且HRO4-不水解;
H++RO42-,且HRO4-不水解;(2)由HRO4-?H++RO42-可知,Na2RO4溶液水解显碱性,水解离子反应为,故答案为:碱性;RO42-+H2O
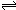 HRO4-+OH-;
HRO4-+OH-;(3)0.1mol/L的NaHRO4溶液中,c(RO42-)=0.029mol/L,0.1mol/L H2RO4溶液,第一步电离对HRO4-?H++RO42-起抑制作用,所以c(RO42-)<0.029mol/L,
故答案为:<;H2RO4第一步电离产生的H+抑制了第二步电离;
(4)NaHRO4溶液中,HRO4-电离,则c(Na+)>c(HRO4-),且电离显酸性,水电离出氢离子,则c(H+)>c(RO42-)>c(OH-),所以离子浓度大小为c(Na+)>c(HRO4-)>c(H+)>c(RO42-)>c(OH-),故答案为:c(Na+)>c(HRO4-)>c(H+)>c(RO42-)>c(OH-).
点评:本题考查离子浓度大小的比较,把握酸的两步电离及电离、水解的判断为解答的关键,注意结合信息及盐类水解规律来解答,题目难度中等.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
 H++ RO42-回答下列问题:
H++ RO42-回答下列问题:
 H++ RO42-回答下列问题:(1)NaHRO4溶液显 (填“酸性”、“中性”或“碱性”),理由是_________
H++ RO42-回答下列问题:(1)NaHRO4溶液显 (填“酸性”、“中性”或“碱性”),理由是_________ H++ RO42-回答下列问题:
H++ RO42-回答下列问题: