��Ŀ����
�⼰�仯������������ռ����Ҫ��λ��
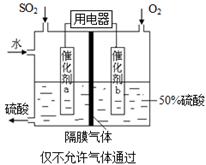
(1)�ӵ�ʳ���к��е����(KIO3)����ҵ���Ե�ⷨ�Ʊ�����أ�����豸��ͼ��ʾ���Ƚ�һ�����ĵ����ڹ�������������Һ��������Ӧ��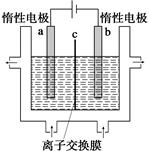
3I2��6KOH=5KI��KIO3��3H2O���ٽ�����Һ���� (����������)������������������Һ��������һ������ʹ�� (������)���ӽ���Ĥ�������������ĵ缫��Ӧʽ�� ��
(2)�⻯�ⲻ�ȶ����ֽⷴӦ���Ȼ�ѧ����ʽ��2HI(g)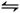 I2(g)+H2(g) ��H="+9.48" kJ��mol��1��֪��S��0
I2(g)+H2(g) ��H="+9.48" kJ��mol��1��֪��S��0
�ٸ÷�Ӧ����( )
A���κ��¶Ⱦ��Է� B���κ��¶Ⱦ����Է� C�������Է� D�������Է�
��һ�������£���Ӧ��һ�����л������ܱ������дﵽƽ�⣬����˵���в���ȷ����( )
A�����£���С�����ƽ�ⳣ������
B�����£���С�����ƽ�ⲻ�ƶ�����ɫ����
C�����ݣ����£�����Ӧ���ʺ�����Ӧ���ʾ�����
D�����ݣ�����������Ͷ��2mol HI���ﵽƽ��ʱ����9.48 kJ ������
��һ���¶��£�ƽ�ⳣ��K=1/4����2L�������У�����4molHI������Ӧ�ﵽƽ�⣬HI��ת���� ��
��1������ �� I-+6OH-��6e-=IO3-+3H2O ��2����C��D ��0.5
���������������1��������֪��ⷨ�Ʊ�����ص�ԭ��Ϊ��KOH���ڵ��������KI��KIO3�Ļ��Һ����Ӧ��ʵ���ǵ����ӷ���ʧ���ӵ�������Ӧ���������ɵ�������ӣ���ϵ��ԭ�����ص���������ʧ���ӵ�������Ӧ������KI��KIO3�Ļ��ҺӦ�������Դ��������������������װ���е�a���������ݵ缫����ʽ��дԭ��ԭ���غ�͵���غ㣬�缫��ӦʽΪ��I-+6OH-��6e-=IO3-+3H2O���ü�����Ӧ����OH����Ӧ�м�����������KOH��Һ���䣬���ӽ���ĤӦ����������ͨ����Ϊ�����ӽ���Ĥ��
��2���ٸ÷�Ӧ��H��0����S��0�����ݷ�Ӧ������оݿ�֪����ʱ��H��T��S<0�����Է����У�ѡC.
��A��ƽ�ⳣ����Ӱ������Ϊ�¶ȣ���ȷ��B���÷�Ӧ������������ϵ����ȣ����£���С�����ƽ�ⲻ�ƶ����������ʵ�Ũ��������ɫ�����ȷ��C�����·�Ӧ���ʼӿ죬��ȷ��D�����淴Ӧ���ص��Dz��ܽ��е��ף�Ͷ��2mol HI���ﵽƽ��ʱ���յ�����С��9.48 kJ������
�� ��ת���ĵ⻯��Ϊx���������η��ó������ʵ�ƽ��Ũ�ȣ�����ƽ�ⳣ������ʽ����⻯���ƽ��Ũ�ȣ�����ת���ʼ��㹫ʽ����ɵá�
���㣺������ԭ�������淴Ӧ���ص㡢�������������ƽ���Ӱ�켰ƽ�����

 ��У����ϵ�д�
��У����ϵ�д����ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����衣
��֪��SO2��g���� O2��g��
O2��g�� SO3��g�� ��H����98 kJ��mol��1��
SO3��g�� ��H����98 kJ��mol��1��
��1��ij�¶��¸÷�Ӧ��ƽ�ⳣ��K��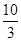 �����ڴ��¶��£���100 L�ĺ����ܱ������У�����3.0 mol SO2(g)��16.0 mol O2(g)��3.0 mol SO3(g)����Ӧ��ʼʱv������ v���棩�����������������������
�����ڴ��¶��£���100 L�ĺ����ܱ������У�����3.0 mol SO2(g)��16.0 mol O2(g)��3.0 mol SO3(g)����Ӧ��ʼʱv������ v���棩�����������������������
��2��һ���¶��£���һ�����������Ϊ2 L���ܱ������г���2.0 mol SO2��1.0 molO2���ﵽƽ��������Ϊ1.6 L����SO2��ƽ��ת����Ϊ ��
��3���ڣ�2���еķ�Ӧ�ﵽƽ��ı�������������ʹSO2(g)ƽ��Ũ�ȱ�ԭ����С���� ������ĸ����
| A�������¶Ⱥ�����������䣬����1.0 mol O2 |
| B�������¶Ⱥ�������ѹǿ���䣬����1.0 mol SO3 |
| C�������¶� |
| D���ƶ�����ѹ������ |
��5��Ϊ�ȶ�����������������Һ��Ũ��Ӧά�ֲ��䣬��ͨ��SO2��ˮ��������Ϊ_____��
KI��Һ����������������������Ӧ����������ʵ���¼��
| ʵ���� | �� | �� | �� | �� | �� |
| �¶ȣ��棩 | 30 | 40 | 50 | 60 | 70 |
| ��ɫʱ�䣨s�� | 160 | 80 | 40 | 20 | 10 |
��1���÷�Ӧ�����ӷ���ʽΪ ��
��2����ʵ���Ŀ���� ��
��3��ʵ���Լ�����1 mol/L KI��Һ��0.1 mol/L H2SO4��Һ�⣬����Ҫ���Լ��� ��ʵ������Ϊ ��
��4������ʵ������г�����Ҫ��3���������⣬��������Ʋ������ (����ĸ)��
A���¶� B���Լ���Ũ�� C���Լ�������(���) D���Լ����ӵ�˳��
��5��������ʵ���¼�ɵó��Ľ����� ��
��6����Ҫ�������ԶԷ�Ӧ���ʵ�Ӱ���̽��ʵ�飬����ȡ�Ĵ�ʩ�� ��
�������������ʡ����ᡢ����ȵ���Ҫԭ�ϡ�
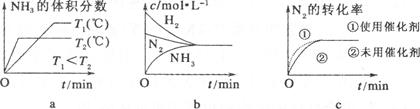
��1��ʵ����ģ��ϳɰ����ں��º����ܱ������а��ռס��ҡ������ַ�ʽ�ֱ�Ͷ�ϣ���λ��mol /L����ƽ��ʱ��ü�������H2��ת����Ϊ20%��
| | N2 | H2 | NH3 |
| �� | 1 | 3 | 0 |
| �� | 0.5 | 1.5 | 1 |
| �� | 0 | 0 | 4 |
��ƽ��ʱ�������а�����Ũ��Ϊ ��
���������п�ʼ��Ӧʱ��v�� v��(�������)��
�۴�ƽ��ʱ���ס��ҡ�����������NH3����������ɴ�С��˳��Ϊ ��
��2����ҵ����NH3��CO2Ϊԭ�Ϻϳ�����[CO(NH2)2]����Ӧ�Ļ�ѧ����ʽΪ��
2NH3 (g)+ CO2 (g)
 CO(NH2)2 (l) + H2O (l)���÷�Ӧ��ƽ�ⳣ�����¶ȹ�ϵ���£�
CO(NH2)2 (l) + H2O (l)���÷�Ӧ��ƽ�ⳣ�����¶ȹ�ϵ���£�| T / �� | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
���ʱ䦤H_____0�����������������������
����һ���¶Ⱥ�ѹǿ�£���ԭ�����е�NH3��CO2�����ʵ���֮�ȣ���̼�ȣ�
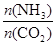 ��x����ͼ�ǰ�̼�ȣ�x����CO2ƽ��ת���ʣ������Ĺ�ϵ��������x����������ԭ���� ��
��x����ͼ�ǰ�̼�ȣ�x����CO2ƽ��ת���ʣ������Ĺ�ϵ��������x����������ԭ���� ��
����ͼ�е�B�㴦��NH3��ƽ��ת����Ϊ ��
(14��)ij��ѧ��Ӧ2A(g) B(g)+D(g)�����ֲ�ͬ�����½��У�B��D��ʼŨ��Ϊ�㣬��Ӧ��A��Ũ��(mol/L)�淴Ӧʱ��(min)�ı仯����������������ݣ����������գ�
B(g)+D(g)�����ֲ�ͬ�����½��У�B��D��ʼŨ��Ϊ�㣬��Ӧ��A��Ũ��(mol/L)�淴Ӧʱ��(min)�ı仯����������������ݣ����������գ�
| ʵ�� ��� | �¶�/�� | ʱ��/min | ||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | ||
| 1 | 800�� | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800�� | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800�� | c 3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820�� | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)��ʵ��l�����У�10 min��20 minʱ������B��ʾ�÷�Ӧ��ƽ����ѧ��Ӧ����Ϊ mol/(L��min)��
(2)��ʵ��2�����У�A�ij�ʼŨ��c2= mol/L����Ӧ��20min�ʹﵽƽ�⣬���Ʋ�ʵ��2�л������������� ��
(3)��ʵ��3�Ļ�ѧ��Ӧ����Ϊv3��ʵ��1�Ļ�ѧ��Ӧ����Ϊv1����v3 v1����c3 1.0 mol/L (���������������=��)��
(4)�Ƚ�ʵ��4��ʵ��l�����Ʋ�÷�Ӧ�� ��Ӧ(����ȡ����ȡ�)��������
��
(14��)��ҵ���������Ҫ��Ӧ��4NH3(g)+5O2(g)  4NO(g)+6H2O(g)��H=-akJ/mol(a��0)
4NO(g)+6H2O(g)��H=-akJ/mol(a��0)
(1)�����4molNH3��5molO2���������У��ﵽƽ��ʱ���ų�����0.8akJ����Ӧʱת�Ƶĵ�����Ϊ
mol
(2)�������������䣬���й�ϵͼ�д������ ��ѡ����ţ�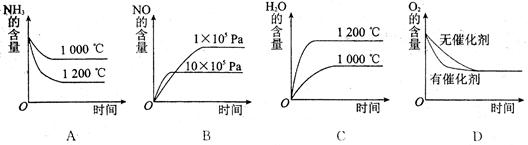
(3)t��ʱ�����ݻ��̶����ܱ������з���������Ӧ�������ڸ����ʵ�Ũ�����±�
| Ũ��(mol/L) ʱ��(min) | c(NH3) | c(O2) | c(NO) | c(H2O) |
| �� ʼ | 4.0 | 5.5 | 0 | 0 |
| ��2min | 3.2 | x | 0.8 | 1.2 |
| ��4min | 2.0 | 3.0 | 2.0 | 3.0 |
| ��6min | 2.0 | 3.0 | 2.0 | 3.0 |
�ٷ�Ӧ�ڵ�2mim����4mimʱ����Ӧ����v(O2)=
�ڵ�2minʱ�ı����������ı������������
A�������¶� B��ʹ���˴��� C����Сѹǿ D��������������
������ͬ���¶��£���ʼ�������м���NH3��O2��NO��H2O(g)��Ũ�ȶ�Ϊ1mol/L����÷�Ӧ���� _______�������(�����Ӧ��.���淴Ӧ��.�����ƶ���)
��4����ҵ����ˮ���ն��������������ᣬ���ɵ�NO2���徭��������������յ�ѭ������ʹ����ת��Ϊ���ᣨ�ٶ�������������������ʧ��������23��NO2����2���������յõ�20�G��ϡ���� �֡�
��5����Ʒ�����Ũ��Ϊ60%��70%��Ϊ����Ũ���ᣬ����Mg(NO3)2����ˮ����Ȼ�����������CaCl2��MgCl2����ˮ����ԭ����__________________________________________
 cC��g������H��0���ڵ��������½��С��ı�������Ӧ�������ڢ����ϵ�и�����Ũ����ʱ��仯����������ͼ��ʾ��
cC��g������H��0���ڵ��������½��С��ı�������Ӧ�������ڢ����ϵ�и�����Ũ����ʱ��仯����������ͼ��ʾ�� 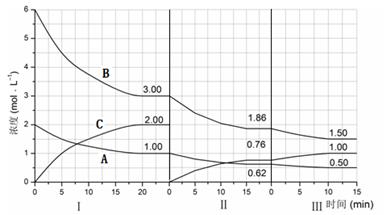

 2C(g)��һ���ܱ������дﵽƽ��ʱ,���c(A2)=0��5mol��L-1��c(B2)=0��1mol��L-1��c(C)=1��6mol��L-1����
2C(g)��һ���ܱ������дﵽƽ��ʱ,���c(A2)=0��5mol��L-1��c(B2)=0��1mol��L-1��c(C)=1��6mol��L-1����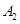 ��
��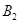 ��C����ʼŨ�ȷֱ�Ϊa mol��L-1��b mol��L-1��g mol��L-1��ȷ����
��C����ʼŨ�ȷֱ�Ϊa mol��L-1��b mol��L-1��g mol��L-1��ȷ����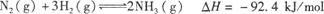 ���ݴ˻ش��������⣺
���ݴ˻ش��������⣺