题目内容
【题目】向2L密闭容器中通入amol气体A和bmol气体B,在一定条件下发生反应:xA(g)+yB(g) ![]() pC(g)+qD(g)已知:平均反应速率v(C)=
pC(g)+qD(g)已知:平均反应速率v(C)= ![]() v(A);反应2min时,A的浓度减少了
v(A);反应2min时,A的浓度减少了![]() ,B的物质的量减少了
,B的物质的量减少了![]() mol,有
mol,有![]() molD生成。回答下列问题:
molD生成。回答下列问题:
(1)反应2min内,v(A)=______________;v(B)=______________;
(2)化学方程式中,x=_______、y=_______、p=_______、q=_______;
(3)下列叙述能说明该反应已达平衡状态的是:__________________;
A、 xV(A)正=qV(D)逆 B、气体总的质量保持不变 C、C的总质量保持不变 D、混合气体总的物质的量不再变化 E、混合气体总的密度不再变化 F、混合气体平均分子量不再变化
(4)反应平衡时,D为2amol,则B的转化率为_______________;
(5)其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较,反应速率__________(是“增大”“减小”或“不变”),理由是_________________________________。
【答案】a/12 mol/(L· min) a/8 mol/(L· min) 2 3 1 5 CDF 6a/5b 增大 体积减小,反应物浓度增大
【解析】
(1)依据题给数据和化学反应速率公式计算;
(2)依据题给数据计算各物质的反应速率,再由化学反应速率之比等于化学计量数之比计算可得;
(3)能判断该反应达到化学平衡状态的依据是各种条件下正逆反应速率是否相等,或各组分的浓度是否不再随时间的改变而改变;
(4)由生成D的物质的量计算B的消耗量,由转化率公式计算可得;
(5)容器体积减小,反应物浓度增大,化学反应速率增大。
(1)由反应2min时,A的浓度减少了![]() 可知,反应2min内,A的浓度变化量为
可知,反应2min内,A的浓度变化量为![]() mol/L,反应速率v(A)=
mol/L,反应速率v(A)=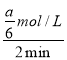 =
=![]() mol/(L· min),由B的物质的量减少了
mol/(L· min),由B的物质的量减少了![]() mol可知B的浓度变化量为
mol可知B的浓度变化量为![]() mol/L,v(B)=
mol/L,v(B)=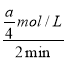 =
=![]() mol/(L· min),故答案为:
mol/(L· min),故答案为:![]() mol/(L· min);
mol/(L· min);![]() mol/(L· min);
mol/(L· min);
(2)由题给数据可知,反应2min内,v(A)= ![]() mol/(L· min)、v(B) =
mol/(L· min)、v(B) =![]() mol/(L· min)、v(C)=
mol/(L· min)、v(C)= ![]() v(A)=
v(A)=![]() mol/(L· min)、v(D)=
mol/(L· min)、v(D)= 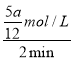 =
=![]() mol/(L· min),由化学反应速率之比等于化学计量数之比可得x:y:p:q=
mol/(L· min),由化学反应速率之比等于化学计量数之比可得x:y:p:q=![]() mol/(L· min):
mol/(L· min):![]() mol/(L· min):
mol/(L· min):![]() mol/(L· min):
mol/(L· min):![]() mol/(L· min)=2:3:1:5,则x=2、y=3、p=1、q=5,故答案为:2;3;1;5;
mol/(L· min)=2:3:1:5,则x=2、y=3、p=1、q=5,故答案为:2;3;1;5;
(3)A、由化学反应速率之比等于化学计量数之比可知,当q
B、由质量守恒定律可知,平衡前后气体质量始终不变,则混合气体的质量不再变化,无法判断是否达到平衡状态,故错误;
C、C为反应物,当C的总质量保持不变时,说明正、逆反应速率相等,反应已达到平衡,故正确;
D、该反应是一个气体体积增大的反应,混合气体总的物质的量不再变化,说明正逆反应速率相等,反应达到平衡状态,故正确;
E、由质量守恒定律可知,平衡前后气体质量始终不变,容积固定的密闭容器中混合气体总的密度始终不变,则混合气体总的密度不再变化,无法判断是否达到平衡状态,故错误;
F、该反应是一个气体体积增大的反应,由质量守恒定律可知,平衡前后气体质量始终不变,平衡形成过程中混合气体平均分子量减小,则混合气体平均分子量不再变化,说明正、逆反应速率相等,反应已达到平衡,故正确;
CDF正确,故答案为:CDF;
(4)反应平衡时,反应生成D的物质的量为2amol,由方程式可知,反应消耗B的物质的量为![]() =
=![]() mol,则B的转化率为
mol,则B的转化率为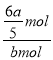 ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%;
×100%;
(5)其他条件不变,将容器的容积变为1L,容器体积减小,反应物浓度增大,化学反应速率增大,故答案为:增大;体积减小,反应物浓度增大。