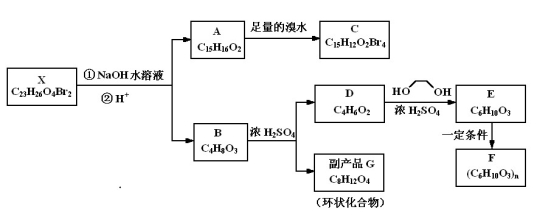
题目内容
汽车的启动电源常用铅蓄电池。其结构如下图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4=2PbSO4+2H2O根据此反应判断下列叙述中正确的是
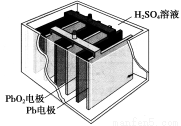
A.PbO2是电池的负极
B.放电时,溶液中的H+向正极区移动,正极区域的溶液的酸性增强
C.放电时,电子由Pb电极通过导线流向PbO2
D.正极的电极反应式为Pb-2e-=Pb2+
C
【解析】
试题分析:A.在该铅蓄电池PbO2是电池的正极 。错误。B.放电时,根据同种电荷相互排斥,异种电荷相互吸引的原则。溶液中的H+向阴极区移动,阴极区域的溶液的酸性增强。错误。C.放电时,Pb失去电子。在负极发生反应:Pb-2e-+SO42-= PbSO4;电子由Pb电极通过导线流向正极PbO2。正确。D.在正极的电极反应式为PbO2+2e-+4H+ +SO42-= PbSO4+2H2O。错误。
考点:考查铅蓄电池在放电时的工作原理的知识。

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目