题目内容
【题目】在极性分子NCl3中,N原子的杂化类型为 , 该分子中氮元素化合价为﹣3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是(填化学式).
【答案】sp3;NH3、HClO
【解析】解:NCl3中含有3个δ键,且孤电子对数为1,所以氮原子的杂化类型为sp3杂化.在极性分子NCl3中,N原子的化合价为﹣3,Cl原子的化合价为+1,NCl3发生水解反应生成氨气和次氯酸,所以其产物是NH3、HClO, 所以答案是:sp3; NH3、HClO.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
【题目】一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:2NO(g)+2CO(g)N2(g)+2CO2(g)
各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如下图所示:
容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
下列说法正确的是( )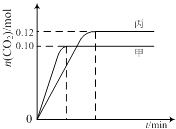
A.该反应的正反应为吸热反应
B.达到平衡时,乙中CO2的体积分数比甲中的小
C.T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2 , 则反应达到新平衡前v(正)<v(逆)
D.T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2 , 则达平衡时N2的转化率大于40%