题目内容
【题目】X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,一般情况下X的单质只有氧化性:
(1)写出实验室制取W2反应的离子方程式:________________________。
(2)某小组设计如图所示的实验装置(图中夹持和加热装置略去),分别研究YX2、W2的性质。
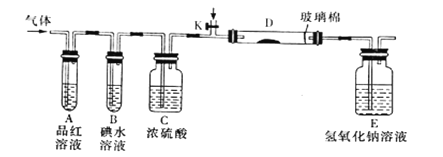
①分别通入YX2和W2,在装置A中观察到的现象是否相同_________________(填“相同”、“不相同”);若装置D中装的是铁粉,当通入W2时D中观察到的现象为__________;若装置D中装的是五氧化二钒,当通入YX2时,打开K通入适量X2,化学方程式为_______________________________________。
②若装置B中装入5.0mL1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,则该反应的化学方程式为__________________。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量_____(填字母)可以看到白色沉淀生成。
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙
(4)如由元素Y和X组成-2价酸根Z,Z中Y和X的质量比为Y:X=4:3,当W2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入足量氯化钡溶液,有白色沉淀产生,且两种沉淀物质量相等。写出W2与Z的溶液完全反应产生浅黄色沉淀的离子方程式_____。
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O相同棕黄色的烟Cl2+SO2+2H2O=H2SO4+2HClI2+5Cl2+6H2O=2HIO3+10HClACCl2+S2O32-+H2O=SO42-+S↓+2H++2Cl-
Mn2++Cl2↑+2H2O相同棕黄色的烟Cl2+SO2+2H2O=H2SO4+2HClI2+5Cl2+6H2O=2HIO3+10HClACCl2+S2O32-+H2O=SO42-+S↓+2H++2Cl-
【解析】
X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,一般情况下X的单质只有氧化性,则X是O,Y 是S,W是Cl。
(1)在实验室一般是用浓盐酸与MnO2共热制取Cl2,反应的离子方程式是MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;正确答案:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;正确答案:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(2)①SO2、Cl2的水溶液都具有漂白性,所以若分别通入SO2和Cl2,在装置A中都会观察到品红溶液褪色,故看到的现象是相同的;若装置D中装的是铁粉,当通入Cl2时,在D中发生反应产生FeCl3,所以D中观察到的现象为产生棕黄色的烟;若装置D中装的是五氧化二钒,当通入SO2时,打开K通入适量Cl2,化学方程式为Cl2+SO2+2H2O=H2SO4+2HCl;正确答案:相同 ; 棕黄色的烟;Cl2+SO2+2H2O=H2SO4+2HCl。
②若装置B中装入5.0mL1.0×10-3mol/L的碘水,n(I2)= 1.0×10-3mol/L×0.005L=5.0×10-6mol,当通入足量Cl2完全反应后,转移了5.0×10-5mol电子,则1molI2失去10mol电子,所以发生反应的化学方程式为I2+5Cl2+6H2O=2HIO3+10HCl;正确答案:I2+5Cl2+6H2O=2HIO3+10HCl。
(3)将足量的SO2通入一支装有氯化钡溶液的试管,由于酸性HCl>H2SO3,所以SO2不能与BaCl2溶液发生复分解反应,未见沉淀生成;
A.向该试管中加入过量氨水,会发生SO2与氨水发生复分解反应产生SO32-,然后与溶液的Ba2+再形成BaSO3白色沉淀,正确;
B.稀盐酸与溶液的成分不能发生反应,不能产生白色沉淀,错误;
C.稀硝酸具有强的氧化性,会把亚硫酸氧化产生硫酸,硫酸与氯化钡溶液发生复分解反应,产生硫酸钡白色沉淀,正确;
D.氯化钙溶液与溶液的成分不能发生反应,因此不能形成白色沉淀,错误;
正确选项AC。
(4)如由元素S和O组成-2价酸根Z,Z中Y和X的质量比为Y:X=4:3,则Z是S2O32-,当Cl2与含S2O32-的溶液完全反应后,有浅黄色沉淀S产生,取上层清液加入足量氯化钡溶液,有白色沉淀产生,且两种沉淀物质量相等。则Cl2与S2O32-的溶液完全反应产生浅黄色沉淀的离子方程式是Cl2+S2O32-+H2O=SO42-+S↓+2H++2Cl-;正确答案:Cl2+S2O32-+H2O=SO42-+S↓+2H++2Cl-。

【题目】在2 L密闭容器内,800 ℃时NO(g)和O2(g)反应生成NO2(g)的体系中,n(NO)随时间的变化如下表所示:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应,在第5 s时,NO的转化率为________。

(2)如图,表示NO2变化曲线的是____,用O2表示从0~2 s内该反应的平均速率v=________。
(3)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效的催化剂
【题目】向1L含0.01molNaAlO2和0.02molNaOH的溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,当0.01mol<n(CO2) ![]() 0.015时发生的反应是:2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3下列对应关系正确的是( )
0.015时发生的反应是:2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3下列对应关系正确的是( )
选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)> c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)> c(HCO3-)>c(CO32-)> c(OH-) |
D | 0.03 | c(Na+)> c(HCO3-)> c(OH-)>c(H+) |
A. A B. B C. C D. D
【题目】(8分)高炉炼铁过程中发生的主要反应为
![]()
已知该反应在不同温度下的平衡常数如下:

请回答下列问题:
(1)该反应的平衡常数表达式K=_____________,△H________0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(C02)= _____________、CO的平衡转化率= _____________:
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
A.减少Fe的量 | B.增加Fe203的量 | C.移出部分C02 |
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂 |



