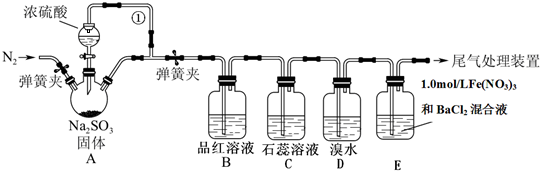
题目内容
(1)某同学设计了如下实验流程:在一个小烧杯里,加入20g Ba(OH)2?8H2O晶体和10gNH4Cl晶体,然后将小烧杯放在事先已滴有3滴~4滴水的玻璃片上,并立即用玻璃棒迅速搅拌.实验流程示意图
如图,回答下列问题:
①实验中玻璃棒的作用是
②浸有稀硫酸的棉花的作用是
③通过
总能量
(2)沼气是一种廉价能源,农村存在大量的秸秆、杂草等废弃物,它们经微生物发酵之后,便可产生
沼气,可用来点火做饭.在农村推广建造沼气池,不仅能有效地利用
供优良的肥料.已知:标准状况下的112.0L CH4气体完全燃烧,生成CO2和液态水,放出4448kJ
的热量.
①写出CH4完全燃烧的热化学方程式为
②如果上述反应生成的是水蒸气,则反应放出的热量
(3)钢铁在潮湿的空气中生锈主要是由电化学腐蚀造成的,发生腐蚀时铁和内部的杂质碳及钢铁表
面的电解质溶液形成原电池.钢铁发生电化学腐蚀时铁作为原电池的
分析:(1)①固体混合物的反应用玻璃棒搅拌有利于充分接触,加速反应进行,快速搅拌使温度快速下降;
②氨气对人有害,不能直接排放,需要进行尾气吸收;
③烧杯和玻璃片之间的水结冰会将二者粘在一起,反应物的总能量小于生成物的总能量,则反应是一个吸热反应;
(2)①依据热化学方程式书写方法,标注物质聚集状态和反应焓变,通过题干条件计算对应物质燃烧反应放出的热量;②水蒸气的能量比液态水的能量高;
(3)中性或弱酸性条件下,钢铁发生吸氧腐蚀,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应.
②氨气对人有害,不能直接排放,需要进行尾气吸收;
③烧杯和玻璃片之间的水结冰会将二者粘在一起,反应物的总能量小于生成物的总能量,则反应是一个吸热反应;
(2)①依据热化学方程式书写方法,标注物质聚集状态和反应焓变,通过题干条件计算对应物质燃烧反应放出的热量;②水蒸气的能量比液态水的能量高;
(3)中性或弱酸性条件下,钢铁发生吸氧腐蚀,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应.
解答:解:(1)①为了使反应物迅速混合而充分反应,使温度迅速下降,从而使反应现象更加明显,所以实验中要立即用玻璃棒迅速搅拌,
故答案为:搅拌使混合物充分接触并反应;
②该反应中有氨气生成,氨气对人体有害的气体,会对环境造成污染,所以不能直接排放到大气中,应该所以完全吸收装置,可以使用稀硫酸吸收,
故答案为:吸收反应中产生的氨气;
③通过玻璃片上结冰现象,可以知道氢氧化钡晶体和氯化铵之间的反应是吸热的,反应物的总能量小于生成物的总能量,故答案为:结冰;吸热;小于;
(2)生物质能主要是指用树木、庄家、草类等植物直接或间接提供的能量,故答案为:生物质;
①标准状况下的112.0L CH4气体完全燃烧,生成CO2和液态水,放出4448kJ的热量,1mol甲烷燃烧生成二氧化碳和液态水放热889.6kJ,反应的热化学方程式为:
CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-889.6kJ/mol,故答案为:CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-889.6kJ/mol;
②水蒸气的能量比液态水的能量高,生成的是水蒸气,放出的能量变小,故答案为:<;
(3)钢铁在潮湿的空气中发生吸氧腐蚀,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+,故答案为:负;Fe-2e-=Fe2+.
故答案为:搅拌使混合物充分接触并反应;
②该反应中有氨气生成,氨气对人体有害的气体,会对环境造成污染,所以不能直接排放到大气中,应该所以完全吸收装置,可以使用稀硫酸吸收,
故答案为:吸收反应中产生的氨气;
③通过玻璃片上结冰现象,可以知道氢氧化钡晶体和氯化铵之间的反应是吸热的,反应物的总能量小于生成物的总能量,故答案为:结冰;吸热;小于;
(2)生物质能主要是指用树木、庄家、草类等植物直接或间接提供的能量,故答案为:生物质;
①标准状况下的112.0L CH4气体完全燃烧,生成CO2和液态水,放出4448kJ的热量,1mol甲烷燃烧生成二氧化碳和液态水放热889.6kJ,反应的热化学方程式为:
CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-889.6kJ/mol,故答案为:CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-889.6kJ/mol;
②水蒸气的能量比液态水的能量高,生成的是水蒸气,放出的能量变小,故答案为:<;
(3)钢铁在潮湿的空气中发生吸氧腐蚀,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+,故答案为:负;Fe-2e-=Fe2+.
点评:本题考查吸热反应、电化学腐蚀等,难度较小,旨在考查学生对基础知识的识记,注意基础知识的积累掌握.

练习册系列答案
相关题目




 (R、R'代表烃基或氢原子)
(R、R'代表烃基或氢原子)



 )的合成路线:
)的合成路线:

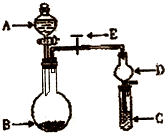 (2010?临沂一模)化学实验中一套装置往往可以完成多个实验,A某同学设计了如图所示装置(夹持仪器省略)进行系列实验.请回答:
(2010?临沂一模)化学实验中一套装置往往可以完成多个实验,A某同学设计了如图所示装置(夹持仪器省略)进行系列实验.请回答: