题目内容
向200 mL 某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液。向上述所得溶液中,逐滴滴加2 mol·L-1的盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
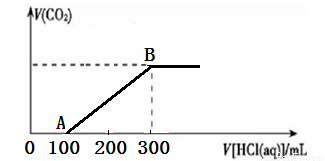
(1)OA段、AB段发生反应的离子方程式__________________、__________________。
(2)B点时,反应所得溶液中溶质的物质的量浓度是______________。
(1)CO32-+H+=HCO3— HCO3– +H+=CO2↑+H2O (2)1.2 mol·L-1
【解析】
试题分析:(1)根据题意知,向某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液,向上述所得溶液中逐滴滴加2 mol·L-1的盐酸发生的反应依次为CO32-+H+═HCO3-,HCO3– +H+=CO2↑+H2O;即OA段、AB段发生反应的离子方程式CO32-+H+═HCO3-,HCO3– +H+=CO2↑+H2O;(2)根据题意知,B点时,反应所得溶液中溶质为NaCl,根据氯元素守恒得,n(NaCl)= n(HCl)=0.3L×2mol/L=0.6mol,则氯化钠的物质的量浓度为1.2mol/L。
考点:考查与化学反应相关的图像分析及守恒法计算。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目