��Ŀ����
����Ŀ��ij��ѧ��ȤС��Ե绯ѧ���������ʵ��̽����
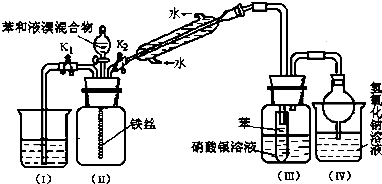
��1����������ͼ1װ��̽�������ķ�����ʩ��ʵ��������п�缫�����ܽ⣬���缫���������ݲ�����
a.д�������ĵ缫��Ӧʽ ��
b.ijѧ����Ϊ�����缫���ܲ��뷴Ӧ�����Բ����������裺
����1�������뷴Ӧ������������Fe2+��
����2�������뷴Ӧ������������Fe3+��
����3�� ��
c.Ϊ��̽������1��2������ȡ���²�����
��ȡ0.01mol/L FeCl3��Һ2mL���Թ��У�����������ۣ�
��ȡ�������Թܵ��ϲ���ҹ����2��K3[Fe��CN��6]��Һ��������ɫ������
��ȡ��������������Һ����2��K3[Fe��CN��6]��Һ��δ����ɫ�������ɣ�
��ȡ��������������Һ����2��KSCN��Һ��δ����Һ��죻
�ݢڡ��ۡ�������ó��Ľ����� ��
d.��ʵ��ԭ����Ӧ���ڷ���������ʴ�����پ�һ������������ʴ�Ĵ�ʩ ��
��2��������ͼ2װ�������50mL 0.5mol/L��CuCl2��Һʵ�飮ʵ���¼��
A���������л���ɫ���������������ʹʪ��ĵ��۵⻯����ֽ�ȱ�������ɫ��
B�����һ��ʱ���Ժ������������ͭ�����⣬���������������ݺ�dz��ɫ���壮
a.����ʵ���¼A����ֽ��ɫ�仯�������ӷ���ʽ���ͣ�
����
�� ��
b.����ʵ���¼B��dz��ɫ�����������д��ѧʽ�����Է������ɸ����ʵ�ԭ�� ��
���𰸡�
��1��Zn��2e��=Zn2+�������뷴Ӧ������������Fe2+��Fe3+������������Һ����Fe2+��Fe3+���ڸ�������ˢһ�����ᡢ��ͭ
��2��2I��+Cl2=I2+2Cl����5Cl2+I2+6H2O=10Cl��+2IO3��+12H+��Cu��OH��2�����ϳ�ʱ���ͭ����Ũ���½��������ӿ�ʼ�ŵ磬��Һ��pH����ͭ����ת��Ϊ������ͭ����
���������⣺��1��I��a.��װ�����Է�����������ԭ��Ӧ���γ�ԭ��أ�п��ʧ���Ӷ������������������������ϵ缫��ӦʽΪZn��2e��=Zn2+ �� ���Դ��ǣ�Zn��2e��=Zn2+��b.�����뷴Ӧ������������Fe2+��Fe3+ �� ���Դ��ǣ������뷴Ӧ������������Fe2+��Fe3+��c.�������Ӻ�K3[Fe��CN��6]������ɫ�����������Ӻ����軯����Һ��Ӧ����Ѫ��ɫ��Һ���ݢڡ��ۡ�������֪������������Һ����Fe2+��Fe3+ �� ���������뷴Ӧ�����Դ��ǣ�����������Һ����Fe2+��Fe3+��d.���Բ���������ѧ������ֹ��������ʴ���磺�ڸ�������ˢһ�����ᡢ��ͭ�ȣ����Դ��ǣ��ڸ�������ˢһ�����ᡢ��ͭ����2��II��a.�������������������ɵⵥ�ʣ����ܱ������������ɵ��ᣬ���ӷ���ʽ�ֱ�Ϊ��2I��+Cl2=I2+2Cl����5Cl2+I2+6H2O=10Cl��+2IO3��+12H+ �� ���Դ��ǣ�2I��+Cl2=I2+2Cl����5Cl2+I2+6H2O=10Cl��+2IO3��+12H+��b.�����ϵ缫��ӦʽΪ��Cu 2++2e��=Cu����ͭ���ӷŵ���Ϻ������ӷŵ磬2H++2e��=H2������ʹ�õ缫�����ʼ��ԣ�Cu 2++2OH��=Cu��OH��2�������Դ��ǣ�Cu��OH��2�����ϳ�ʱ���ͭ����Ũ���½��������ӿ�ʼ�ŵ磬��Һ��pH����ͭ����ת��Ϊ������ͭ������

 �������ϵ�д�
�������ϵ�д�����Ŀ��ijͬѧ�����ͼ��ʾװ�÷ֱ����̽��ʵ�飨�г�װ������ȥ�� 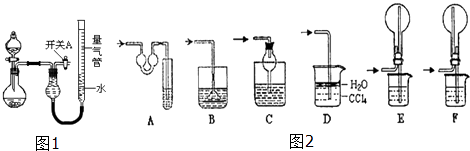
ʵ�� | ҩƷ | ��ȡ���� | �������е�Һ�� |
�� | Cu��ϡHNO3 | H2O | |
�� | NaOH���塢Ũ��ˮ | NH3 | |
�� | Na2CO3���塢ϡH2SO4 | CO2 | |
�� | þ���Ͻ�NaOH��Һ�������� | H2 | H2O |
��ش��������⣺
��1��������μ���װ�õ������ԣ� ��
��2����ͬѧ��Ϊʵ��ٿ�ͨ���ռ�����NO������������̽��Cu��Ʒ�Ĵ��ȣ�����Ϊ�Ƿ���У������ԭ�� ��
��3��ʵ�����ʣ���NH3�����մ��������¸���β������װ���У��ʺ�������NH3 �� �����ܷ�ֹ��������
��4��ʵ����У��������е�Һ������� ��
A.H2O
B.CCl4
C.����Na2CO3��Һ
D.����NaHCO3��Һ
��5����ʵ��Ӧ�������ܶ�ζ���������ʱӦע�⣺ �ٻָ������£��� �� �������밼Һ����ʹ���ƽ��
��6��ʵ��ܻ���������ݣ���������������ѻ���ɱ�״����
��� | þ���Ͻ����� | �����ܵ�һ�ζ��� | �����ܵڶ��ζ��� |
�� | 1.0g | 10.0mL | 346.3mL |
�� | 1.0g | 10.0mL | 335.0mL |
�� | 1.0g | 10.0mL | 345.7mL |
���������������ݼ���þ���Ͻ��������������� ��
����Ŀ��Na��Cu��Fe��Cl��O��N�dz�����6��Ԫ�أ�
��1��Feλ��Ԫ�����ڱ������ڵ��壻O�Ļ�̬ԭ�Ӻ�������δ�ɶԵ��ӣ�Cu�Ļ�̬ԭ�ӵ����Ų�ʽΪ ��
��2���á�����������գ�
��һ������ | ԭ�Ӱ뾶 | �ȶ��� |
NO | CNa | NH3H2O |
��3��Һ̬N2H4��Һ̬N2O4��Ӧ������̬ˮ����25�桢101kPa�£���֪�÷�Ӧÿ����1mol N2H4�ų�519.85kJ���������÷�Ӧ���Ȼ�ѧ��Ӧ����ʽ�ǣ�
��4�����ϵĵ����������õ��Ʊ�N2H4�ķ�����NaClO��Һ����������NH3 �� д���÷�Ӧ�����ӷ���ʽ�����������ת�Ƶķ������Ŀ ��