��Ŀ����
����Ŀ������A��B��C��D���ֶ����ڷǽ���Ԫ�أ����ǵ�ԭ������������֮��Ϊ19�������ǵĻ������У���Ҫ���ϼ۾���ֹһ�֣�����һ����ͬ�Ļ��ϼۣ����ǵIJ����������£�
Ԫ�� | A | B | C | D |
ԭ�Ӱ뾶/nm | 0.102 | 0.077 | 0.117 | 0.075 |
��������ϼ� | ��4 | +4 |
��1��AԪ����Ԫ�����ڱ��е�λ��Ϊ ��
��2����DԪ�ص����ֳ������ۻ���������Ϸ�Ӧ������һ�����ӻ�����÷�Ӧ�Ļ�ѧ����ʽΪ ��
��3��B�ĵ�����D������������Ӧ��ˮ�����ڼ��������·�����Ӧ�Ļ�ѧ����ʽΪ ��
��4��C������Al����ijЩ�����ԣ���������ǿ�Ӧ��д��C������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ�� ��
��5��A��B��C��D�����γɷ����к�18���ӵ��⻯���Щ�⻯��ķ���ʽ�ֱ�Ϊ ��
���𰸡�
��1���������ڢ�A��
��2��NH3+HNO3�TNH4NO3
��3��C+4HNO3��Ũ�� ![]() ?4NO2��+CO2��+2H2O
?4NO2��+CO2��+2H2O
��4��Si+2NaOH+H2O�TNa2SiO3+2H2��
��5��H2S��C2H6��SiH4��N2H4
���������⣺������Ԫ���У�B������۩�4��C���������+4�����ߴ���IVA�壬��C��ԭ�Ӱ뾶��B�Ĵ�BΪ̼Ԫ�ء�CΪSi����Ԫ��ԭ������������֮��Ϊ19����A��Dԭ�ӵ�����������֮��Ϊ19��4��4=11����֪A��D������������ֻ����5��6����ԭ�Ӱ뾶A��Si��̼��D������Ԫ�ؾ�����ͬ�Ļ��ϼ�ӦΪ+4�ۣ���֪AΪSԪ�ء�DΪNԪ�أ�
��1.��AΪSԪ�أ���Ԫ�����ڱ��е�λ��Ϊ���������ڢ�A�壬���Դ��ǣ��������ڢ�A�壻
��2.����NԪ�ص����ֳ������ۻ���������Ϸ�Ӧ������һ�����ӻ�����÷�Ӧ�Ļ�ѧ����ʽΪ��NH3+HNO3�TNH4NO3 �� ���Դ��ǣ�NH3+HNO3�TNH4NO3��
��3.��D������������Ӧ��ˮ����Ϊ���ᣬ̼����Ũ�����ڼ��������·�����Ӧ�Ļ�ѧ����ʽΪ��C+4HNO3��Ũ�� ![]() 4NO2��+CO2��+2H2O�����Դ��ǣ�C+4HNO3��Ũ��
4NO2��+CO2��+2H2O�����Դ��ǣ�C+4HNO3��Ũ�� ![]() 4NO2��+CO2��+2H2O��
4NO2��+CO2��+2H2O��
��4.��Si��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��Si+2NaOH+H2O�TNa2SiO3+2H2�������Դ��ǣ�Si+2NaOH+H2O�TNa2SiO3+2H2����
��5.����̼���衢�������γɷ����к�18���ӵ��⻯���Щ�⻯��ķ���ʽ�ֱ�Ϊ��H2S��C2H6��SiH4��N2H4 �� ���Դ��ǣ�H2S��C2H6��SiH4��N2H4 ��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����1������P(s)��Cl2(g)������Ӧ����PCl3(g)��PCl5(g),��Ӧ�������¡�
2P(s)+3Cl2(g)=2PCl3(g) ��H=-612kJ/mol
2P(s)+5Cl2(g)=2PCl5(g) ��H=-798kJ/mol
��̬PCl5������̬PCl3��Cl2���Ȼ�ѧ����ʽΪ________.
��2����ͬ�¶��·�ӦCO(g)+H2O(g)![]() CO2(g)+H2(g) ��H1��ƽ�ⳣ�����±���ʾ��
CO2(g)+H2(g) ��H1��ƽ�ⳣ�����±���ʾ��
�¶�/�� | 400 | 500 | 800 |
ƽ�ⳣ��K | 9.94 | 9 | 1 |
����H1______0(����<����>��)����500��ʱ���ѵ����ʵ���Ũ�ȵ�CO��H2O(g)���뷴Ӧ�������ﵽƽ��ʱc(CO)=0.005mol/L��c(H2)=0.015mol/L,��CO��ƽ��ת����Ϊ______��
��3����һ������ľ����ܱ������У����ڷ�Ӧ2SO2(g)+O2(g)![]() 2SO3(g) ��H<0,�жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��_____________��
2SO3(g) ��H<0,�жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��_____________��
A.SO2��SO3Ũ�����
B.�����л��������ܶȱ��ֲ���
C.������������¶ȱ��ֲ���
D.SO3������������SO2�������������
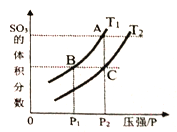
���¶�ΪT1��T2ʱ��ƽ����ϵSO3�����������ѹǿ�仯��������ͼ��ʾ����T1____T2 (����>������<")��������_____�������ӿ�����Ӧ�����ʣ����˸ı��¶ȣ���������_______������
����Ŀ��������ʵ�鼰�������Ƴ���Ӧ���۵���
ʵ�� | ���� | ���� | |
A | ��2mL0.1mol��L-1��FeCl3��Һ�м��������ۣ�����1��KSCN��Һ | ��ɫ������ʧ����KSCN��Һ��ɫ���� | ��ԭ�ԣ�Fe>Fe2+ |
B | ����������ȼ�ճ��е�ȼ��Ѹ�����뼯��CO2�ļ���ƿ | ����ƿ�в����������̣�ƿ���к�ɫ�������� | CO2���������� |
C | ����ʢ����NH4HCO3������Թܣ������Թܿڷ���ʪ��ĺ�ɫʯ����ֽ | ʯ����ֽ���� | NH4HCO3�Լ��� |
D | ��2֧ʢ��2mL��ͬŨ��������Һ���Թ��зֱ����2����ͬŨ�ȵ�NaCl��NaI��Һ | һֻ�Թ��в�����ɫ��������һ֧������������ | Ksp(AgI)<Ksp(AgCl) |
A. A B. B C. C D. D