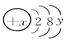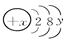题目内容
(1)已知某粒子的结构示意图为: .试回答:
.试回答:
①当x-y=10时,该粒子为
?②当y=8时,阳离子或阴离子可能为(填离子符号):
 、
、
 .
.
(2)原子序数大于4 的主族元素A和B的离子Am+和Bn-它们的核外电子排布相同,据此推断:元素A 和B 所属周期序数之差为
 .试回答:
.试回答:①当x-y=10时,该粒子为
原子
原子
(填“原子”、“阳离子”或“阴离子”).?②当y=8时,阳离子或阴离子可能为(填离子符号):
Cl-
Cl-
、S2-
S2-
、K+
K+
、Ca2+
Ca2+
.若它们形成化合物时离子数之比为1:2,则这些化合物的电子式为



(2)原子序数大于4 的主族元素A和B的离子Am+和Bn-它们的核外电子排布相同,据此推断:元素A 和B 所属周期序数之差为
1
1
;元素A 和B 的原子序数之差为m+n
m+n
;元素B 和A 的最高化合价之差为8-n-m
8-n-m
.分析:(1)根据核内质子数与核外电子数是否相等判断是粒子的类型;先根据离子中核内质子数不等于核外电子数,得出离子的核内质子数,然后求出元素原子的种类;根据元素的化合价之和等于0;
(2)根据题意推导出元素A和B所属周期序数,根据元素A和B的离子Am+和Bn-它们的核外电子排布相同,即核外电子数相等:ZA-m=ZB+n,根据主族元素族序数=最外层电子数=元素的最高化合价,最高正价与最低负价的绝对值之和等于8.
(2)根据题意推导出元素A和B所属周期序数,根据元素A和B的离子Am+和Bn-它们的核外电子排布相同,即核外电子数相等:ZA-m=ZB+n,根据主族元素族序数=最外层电子数=元素的最高化合价,最高正价与最低负价的绝对值之和等于8.
解答:解:(1)①当x-y=10时,核内质子数为x,核外电子数为2+8+y,两者相等,所以该粒子为原子,故答案:原子;
②当y=8时,该离子的核外电子数为18,而离子中核内质子数不等于核外电子数,则该离子的核内质子数为:20、19、17、16等,所以这些粒子为Cl-、S2-、K+、Ca2+,它们形成化合物时离子数之比为1:2的化合物有:K2S、CaCl2,其电子式为:
 ,故答案为:Cl-、S2-、K+、Ca2+;
,故答案为:Cl-、S2-、K+、Ca2+; 、
、 ;
;
(2)因Am+和Bn-核外电子排布相同,故A原子比B原子多一个电子层,故二者的周期数之差为1;因Am+和Bn-核外电子排布相同即核外电子数相等:ZA-m=ZB+n,则ZA-ZB=m+n;B的族序数为8-n,A的族序数为m,B和A的族序数之差为8-n-m.故答案为:1;m+n;8-n-m.
②当y=8时,该离子的核外电子数为18,而离子中核内质子数不等于核外电子数,则该离子的核内质子数为:20、19、17、16等,所以这些粒子为Cl-、S2-、K+、Ca2+,它们形成化合物时离子数之比为1:2的化合物有:K2S、CaCl2,其电子式为:

 ,故答案为:Cl-、S2-、K+、Ca2+;
,故答案为:Cl-、S2-、K+、Ca2+; 、
、 ;
;(2)因Am+和Bn-核外电子排布相同,故A原子比B原子多一个电子层,故二者的周期数之差为1;因Am+和Bn-核外电子排布相同即核外电子数相等:ZA-m=ZB+n,则ZA-ZB=m+n;B的族序数为8-n,A的族序数为m,B和A的族序数之差为8-n-m.故答案为:1;m+n;8-n-m.
点评:本题主要考查原子结构,核电荷数、原子序数、核外电子数之间的关系,元素在周期表中的位置与结构的关系.

练习册系列答案
相关题目


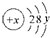 ,试回答:
,试回答: