��Ŀ����
����Ŀ��1942 �꣬�ҹ�����ר�Һ�°��� NaCl��NH3��CO2 ��Ϊԭ�����Ƶ� NaHCO3��������������� �����������Ƽ��Ϊ�����Ƽҵ������ͻ�����ס��йط�Ӧ�Ļ�ѧ����ʽ���£�
NH3��CO2��H2O=NH4HCO3 ��
NH4HCO3��NaCl=NaHCO3����NH4Cl ��
2NaHCO3![]() Na2CO3��CO2����H2O
Na2CO3��CO2����H2O
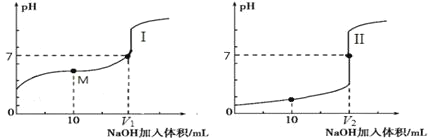
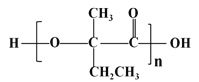
(1)�������Ƽ���Ѻϳɰ��ʹ������ֲ�Ʒ������������д����ҵ�ϳɰ��Ļ�ѧ��Ӧ����ʽ_______
(2)̼������뱥��ʳ��ˮ��Ӧ��������̼�����ƾ����ԭ����_______��
a��̼������������ˮ
b��̼�����������ֽ�
c��̼�����Ƶ��ܽ����Խ�С����������Һ�����Ƚᾧ����
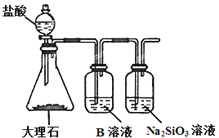
(3)ij̽���С����������Ƽ�ԭ�������Ʊ�̼�����ƣ�ͬѧ�ǰ�������Ƶķ�������ʵ�顣
��һλͬѧ����������̼����ͨ�뺬���ı���ʳ��ˮ���Ʊ�̼�����ƣ�ʵ��װ����ͼ��ʾ(ͼ�мг֡��̶��õ�����δ����)��

��ش�
��д�����з�����Ӧ�����ӷ���ʽ_______��
����װ���е��Լ���_______��
��ʵ���������� NaHCO3 ����IJ�����_______ (��������������)��
�ڶ�λͬѧ������ͼװ�ý���ʵ��(����װ��δ����)��

��Ϊ��߶�����̼�ڴ˷�Ӧ��Һ�б����յij̶ȣ�ʵ��ʱ�����ȴ� a ��ͨ��_______���壬�ٴ�b ����ͨ��_______���塣
��װ�� c �е��Լ�Ϊ_______(ѡ����ĸ)��
e����ʯ�� f.��Ũ���� g����ˮ�Ȼ���
���𰸡�N2 + 3H2![]() 2NH3 c CaCO3 + 2H+= Ca2++ H2O + CO2�� ����̼��������Һ ���� NH3(��) CO2 (������̼) g
2NH3 c CaCO3 + 2H+= Ca2++ H2O + CO2�� ����̼��������Һ ���� NH3(��) CO2 (������̼) g
��������
(1)��ҵ�ϳɰ���Ӧ������N2��H2�ڸ��¡���ѹ��������������NH3��
(2)a��̼������������ˮ��
b��̼�����ƹ�̬ʱ�����ֽ⣬��ˮ��Һ�����Ȳ��ֽ⣻
c��̼�����Ƶ��ܽ����Խ�С���ᾧ��������ʹƽ���������﷽���ƶ���
(3)��һλͬѧ����������̼����ͨ�뺬���ı���ʳ��ˮ���Ʊ�̼�����ƣ�
��װ���У�CaCO3�����ᷴӦ��CO2���壬��CO2�л���HCl�����м��뱥��NaHCO3��Һ���Գ�ȥCO2�е�HCl���ڱ�װ���У�CO2ͨ�뺬���ı���ʳ��ˮ�У�����NaHCO3��NH4Cl����װ������������δ��ӦCO2�ݳ���NH3��
�ڶ�λͬѧ������ͼװ�ý���ʵ��(����װ��δ����)��
����CO2��ˮ�е��ܽ�Ȳ�������Ӧ��ͨNH3����ͨCO2�����������δ��Ӧ��NH3��
(1) ��ҵ�ϳɰ���Ӧ������N2��H2�ڸ��¡���ѹ��������������NH3����Ӧ����ʽN2 + 3H2![]() 2NH3����Ϊ��N2 + 3H2
2NH3������N2 + 3H2![]() 2NH3��
2NH3��
(2) a��̼������������ˮ��a�������⣻
b��̼�����ƹ�̬ʱ�����ֽ⣬�Ժ�°��ƼӦ������Ӱ�죬b�������⣻
c��̼�����Ƶ��ܽ����Խ�С���ᾧ��������ʹƽ���������﷽���ƶ����Ӷ�ʹNaHCO3�ᾧ������c�������⣻
��ѡc��
(3) ��һλͬѧ����������̼����ͨ�뺬���ı���ʳ��ˮ���Ʊ�̼�����ƣ�
�ټ���CaCO3�����ᷴӦ��CO2���壬���ӷ���ʽΪCaCO3 + 2H+= Ca2++ H2O + CO2������Ϊ��CaCO3 + 2H+= Ca2++ H2O + CO2����
����װ�õ������dz�ȥCO2�е�HCl�����Լ��뱥��NaHCO3��Һ����Ϊ������̼��������Һ��
��ʵ���������� NaHCO3�ᾧ�����������˹�����Һ��IJ����ǹ��ˣ���Ϊ�����ˣ�
�ڶ�λͬѧ������ͼװ�ý���ʵ��(����װ��δ����)��
������CO2��ˮ�е��ܽ�Ȳ�������Ӧ��ͨNH3����ͨCO2������ a ��ͨ��NH3(��)���壬�ٴ�b ����ͨ��CO2 (������̼)���壻��Ϊ��NH3(��)��CO2 (������̼)��
��e����ʯ�ң����������������ƵĻ�����������NH3��e�������⣻
f.��Ũ�����Һ̬�����ܷ��ڸ�����ڣ�f�������⣻
g����ˮ�Ȼ��Ƴʹ�̬���ܹ����ڸ�����ڣ���������NH3��g�������⣻
��ѡg��

����Ŀ����ͼ��ʾװ�ü�����ϩʱ����Ҫ���ӵ���

��ϩ���Ʊ� | �Լ�X | �Լ�Y | |
A | CH3CH2Br��NaOH�Ҵ���Һ���� | H2O | KMnO4������Һ |
B | CH3CH2Br��NaOH�Ҵ���Һ���� | H2O | Br2��CCl4��Һ |
C | CH3CH2OH��ŨH2SO4������170�� | NaOH��Һ | KMnO4������Һ |
D | CH3CH2OH��ŨH2SO4������170�� | NaOH��Һ | Br2��CCl4��Һ |
����Ŀ���±��������Ԫ�����ڱ���һ����Ԫ�أ��ش��������⣺
1 | ||||||||||||||||||
2 | A | B | C | |||||||||||||||
3 | D | E | F | G | H | I | J | K | ||||||||||
4 | M | |||||||||||||||||
��1�����ϱ�����ĸ�����12��Ԫ���У���ѧ��������õ���____����Ԫ�ط��ű�ʾ����ͬ������������ǿ����___����ϡ�����������������ԭ�Ӱ뾶��С����____�����ڹ���Ԫ�ص���___���ÿո��ñ��е���ĸ��ʾ����
��2��J���⻯��ĵ���ʽΪ____������������Ӧ��ˮ����Ļ�ѧʽΪ___��
��3��Ϊ�Ƚ�Ԫ��A��G�ķǽ�����ǿ��������ͼ��ʾ��װ�ý���ʵ�飨�г���������ȥ��װ�����������ã�����ҺBӦ��ѡ��_____��Һ��������_____����˵��A��G�ǽ�����ǿ���Ļ�ѧ����ʽ��______��
����Ŀ����֪Ksp(CaCO3)=2.8��10-9�������й���Ϣ:
���� | CH3COOH | H2CO3 |
����ƽ�ⳣ��(����) | Ka=1.8��10-5 | Ka1=4.3��10-7�� Ka2=5.6��10-11 |
�����ж���ȷ����
A. ��Na2CO3��Һ�е����̪,��Һ��죬��Ҫԭ����CO32��+2H2O![]() H2CO3+2OH��
H2CO3+2OH��
B. ����ʱ��CH3COOH��CH3COONa�����Һ��pH=6����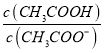 ��18
��18
C. NaHCO3��Һ��:c(OH-)-c(H+)=c(H2CO3)-c(CO32��)
D. 2��10-4 mol/L��Na2CO3��Һ��CaCl2��Һ�������ϳ��ֳ�������CaCl2��Һ��Ũ��һ����5.6��10-5 mol/L