题目内容
14.工业上用乙烯和氯气为原料合成聚氯乙烯(PVC).以乙烯为原料制取PVC等产品的转化关系如图所示.
已知:R-Cl$→_{加热}^{NaOH水溶液}$ R-OH
次氯酸能跟乙烯发生加成反应:CH2=CH2+HOCl→CH2(OH)CH2Cl.
试回答下列问题:
(1)写出有机物B的结构简式:BCH2=CHCl;
(2)⑤的反应类型是加成反应;
(3)D的同分异构体有2种.
(4)写出反应⑥的化学方程式2C2H5OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O;
(5)写出C与D按物质的量之比为1:2反应生成H的化学方程式2CH3COOH+HOCH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O.
分析 乙烯发生加聚反应得到高聚物G为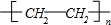 ,乙烯与水发生加成反应生成E为CH3CH2OH,乙醇在催化剂条件下发生氧化反应生成F为CH3CHO,CH3CHO可进一步氧化得到D为CH3COOH,反应①为乙烯与次氯酸发生加成反应生成A为HOCH2CH2Cl,A发生水解反应生成C为HOCH2CH2OH,(5)中C与D按物质的量之比为1:2反应生成H,则H为CH3COOCH2CH2OOCCH3,A发生消去反应生成B为CH2=CHCl,B在发生加聚反应得到PVC为
,乙烯与水发生加成反应生成E为CH3CH2OH,乙醇在催化剂条件下发生氧化反应生成F为CH3CHO,CH3CHO可进一步氧化得到D为CH3COOH,反应①为乙烯与次氯酸发生加成反应生成A为HOCH2CH2Cl,A发生水解反应生成C为HOCH2CH2OH,(5)中C与D按物质的量之比为1:2反应生成H,则H为CH3COOCH2CH2OOCCH3,A发生消去反应生成B为CH2=CHCl,B在发生加聚反应得到PVC为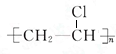 ,据此解答.
,据此解答.
解答 解:乙烯发生加聚反应得到高聚物G为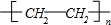 ,乙烯与水发生加成反应生成E为CH3CH2OH,乙醇在催化剂条件下发生氧化反应生成F为CH3CHO,CH3CHO可进一步氧化得到D为CH3COOH,反应①为乙烯与次氯酸发生加成反应生成A为HOCH2CH2Cl,A发生水解反应生成C为HOCH2CH2OH,(5)中C与D按物质的量之比为1:2反应生成H,则H为CH3COOCH2CH2OOCCH3,A发生消去反应生成B为CH2=CHCl,B在发生加聚反应得到PVC为
,乙烯与水发生加成反应生成E为CH3CH2OH,乙醇在催化剂条件下发生氧化反应生成F为CH3CHO,CH3CHO可进一步氧化得到D为CH3COOH,反应①为乙烯与次氯酸发生加成反应生成A为HOCH2CH2Cl,A发生水解反应生成C为HOCH2CH2OH,(5)中C与D按物质的量之比为1:2反应生成H,则H为CH3COOCH2CH2OOCCH3,A发生消去反应生成B为CH2=CHCl,B在发生加聚反应得到PVC为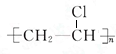 ,
,
(1)由上述分析可知,B的结构简式为CH2=CHCl,故答案为:CH2=CHCl;
(2)反应⑤是乙烯与水发生加成反应生成乙醇,故答案为:加成反应;
(3)D(CH3COOH)的同分异构体的结构简式为:HCOOCH3、HOCH2CHO,故答案为:HCOOCH3或HOCH2CHO;
(4)反应⑥是乙醇氧化生成乙醛,反应化学方程式为:2C2H5OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,故答案为:2C2H5OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O;
(5)C与D按物质的量之比为1:2反应生成H的化学方程式:2CH3COOH+HOCH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O,故答案为:2CH3COOH+HOCH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O.
点评 本题考查有机物推断,涉及烯、醇、醛、羧酸之间的转化关,难度不大,注意基础知识的理解掌握.

 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案| A. | 乙醇和乙酸 | B. | 乙炔和乙醛 | C. | 乙烷和乙酸甲酯 | D. | 乙烯和乙醇 |
| A. | 钠原子和氯原子作用生成NaCl后,其结构的稳定性增强 | |
| B. | 任何离子键在形成的过程中必定有电子的得与失 | |
| C. | 在氯化钠中,氯离子和钠离子靠静电作用结合 | |
| D. | 金属钠与氯气反应生成氯化钠后,体系能量降低 |
| A. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O | |
| B. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| C. | 二氧化氮通入水中:3NO2+H2O=2H++2NO3-+NO | |
| D. | 氯气通入水中的反应:Cl2+H2O=2H++Cl-+ClO- |
| A. | 0.1 mol•L-1盐酸的澄清透明溶液:Fe3+、K+、SO${\;}_{4}^{2-}$、Br- | |
| B. | 含有硝酸钠的溶液:H+、Fe2+、Cl-、SO${\;}_{4}^{2-}$ | |
| C. | 能使石蕊变红的溶液:Cu2+、Na+、AlO${\;}_{2}^{-}$、Cl- | |
| D. | 由水电离出的c(H+)•c(OH-)=10-22的溶液:Na+、Ca2+、HCO${\;}_{3}^{-}$、NO${\;}_{3}^{-}$ |


 .
.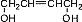 .
.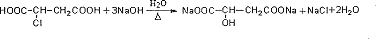 .
. 等.
等. .(2)HClO:
.(2)HClO: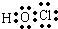 .
.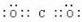 .(4)MgCl2:
.(4)MgCl2: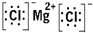 .
. . (6)H2S:
. (6)H2S: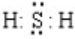 .
.