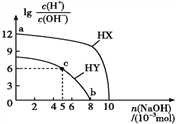
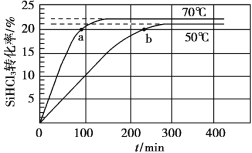
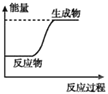
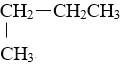题目内容
【题目】镁铝合金3.9g溶于200mL2mol·L1的盐酸,在标准状况下放出气体的体积为4.48L。向反应后的溶液中加入足量氨水,产生沉淀的质量为( )
A.3.9gB.9.0gC.10.7gD.12.4g
【答案】C
【解析】
发生反应Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,4.48L气体是氢气,氢气的物质的量为:![]() =0.20mol,故参加反应的HCl的物质的量为0.20mol×2=0.4mol,溶液中n(HCl)=0.2L×2mol·L-1=0.4mol,等于参加反应的HCl的物质的量,故金属不一定完全反应,反应后溶液中加入足量氨水,则镁离子、铝离子恰好完全转化为Mg(OH)2、Al(OH)3,则m(沉淀)=m(金属)+m(OH-),由生成的氢气的物质的量,根据电子注意守恒计算n(OH-),再根据m=nM计算m(OH-),最后计算出沉淀的质量。
=0.20mol,故参加反应的HCl的物质的量为0.20mol×2=0.4mol,溶液中n(HCl)=0.2L×2mol·L-1=0.4mol,等于参加反应的HCl的物质的量,故金属不一定完全反应,反应后溶液中加入足量氨水,则镁离子、铝离子恰好完全转化为Mg(OH)2、Al(OH)3,则m(沉淀)=m(金属)+m(OH-),由生成的氢气的物质的量,根据电子注意守恒计算n(OH-),再根据m=nM计算m(OH-),最后计算出沉淀的质量。
发生反应Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,4.48L气体是氢气,氢气的物质的量为:![]() =0.20mol,故参加反应的HCl的物质的量为0.20mol×2=0.4mol,溶液中n(HCl)=0.2L×2mol·L-1=0.4mol,等于参加反应的HCl的物质的量,故金属不一定完全反应,反应后溶液中加入足量氨水,则镁离子、铝离子恰好完全转化为Mg(OH)2、Al(OH)3,则m(沉淀)=m(金属)+m(OH-),根据电子注意守恒可知:n(OH-)=2n(H2)=0.20mol×2=0.4mol,所以生成沉淀的质量为:3.9g+0.4mol×17g·mol-1=10.7g,故选C。
=0.20mol,故参加反应的HCl的物质的量为0.20mol×2=0.4mol,溶液中n(HCl)=0.2L×2mol·L-1=0.4mol,等于参加反应的HCl的物质的量,故金属不一定完全反应,反应后溶液中加入足量氨水,则镁离子、铝离子恰好完全转化为Mg(OH)2、Al(OH)3,则m(沉淀)=m(金属)+m(OH-),根据电子注意守恒可知:n(OH-)=2n(H2)=0.20mol×2=0.4mol,所以生成沉淀的质量为:3.9g+0.4mol×17g·mol-1=10.7g,故选C。

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目