题目内容
(2011?朝阳区二模)已知某溶液中只存在OH-、H+、Cl-、NH4+四种离子,其离子浓度可能有如下关系:下列说法正确的是( )
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(NH4+)=c(Cl-)>c(OH-)=c(H+)
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(NH4+)=c(Cl-)>c(OH-)=c(H+)
分析:①c(H+)>c(OH-)溶液呈酸性,可能为NH4Cl溶液或NH4Cl与HCl的混合物;
②c(OH-)>c(H+)溶液呈碱性,可能为NH4Cl与一水合氨的混合物;
③(OH-)>c(H+)溶液呈碱性,可能为NH4Cl与一水合氨的混合物;
④当溶液呈中性,c(OH-)=c(H+),溶液中存在电荷守恒:c(Cl-)+c(OH-)=c(NH4+)+c(H+).
②c(OH-)>c(H+)溶液呈碱性,可能为NH4Cl与一水合氨的混合物;
③(OH-)>c(H+)溶液呈碱性,可能为NH4Cl与一水合氨的混合物;
④当溶液呈中性,c(OH-)=c(H+),溶液中存在电荷守恒:c(Cl-)+c(OH-)=c(NH4+)+c(H+).
解答:解:A、若①正确,根据c(H+)>c(OH-)溶液呈酸性,则溶液可能为NH4Cl溶液或NH4Cl与少量HCl的混合物,两种情况下,c(Cl-)>c(NH4+)>c(H+)>c(OH-)均成立,故A错误;
B、若③正确,根据c(OH-)>c(H+)知溶液呈碱性,可能为NH4Cl与一水合氨的混合物,此时c(NH3?H2O)+c(NH4+)>c(Cl-)一定成立,故B正确;
C、若④正确,c(OH-)=c(H+),溶液呈中性,溶液中存在电荷守恒:c(Cl-)+c(OH-)=c(NH4+)+c(H+),
所以c(NH4+)=c(Cl),当盐酸和氨水体积相等时,盐酸中c(H+)小于,故C错误;
D、溶质不同时,②中当c(Cl-)>c(NH4+)>c(OH-)>c(H+)时,c(Cl-)+c(OH-)≠c(NH4+)+c(H+),则电荷不守恒,所以关系式不可能成立,故D错误.
故选B.
B、若③正确,根据c(OH-)>c(H+)知溶液呈碱性,可能为NH4Cl与一水合氨的混合物,此时c(NH3?H2O)+c(NH4+)>c(Cl-)一定成立,故B正确;
C、若④正确,c(OH-)=c(H+),溶液呈中性,溶液中存在电荷守恒:c(Cl-)+c(OH-)=c(NH4+)+c(H+),
所以c(NH4+)=c(Cl),当盐酸和氨水体积相等时,盐酸中c(H+)小于,故C错误;
D、溶质不同时,②中当c(Cl-)>c(NH4+)>c(OH-)>c(H+)时,c(Cl-)+c(OH-)≠c(NH4+)+c(H+),则电荷不守恒,所以关系式不可能成立,故D错误.
故选B.
点评:本题综合考查盐类的水解、弱电解质的电离以及离子浓度的大小比较,题目难度较大,注意把握盐类的水解以及弱电解质电离的特征,把握比较离子浓度大小顺序的方法.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目






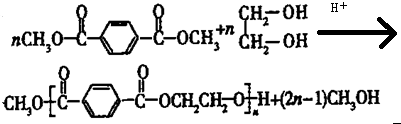
 合成
合成 的流程图.(注明反应条件)
的流程图.(注明反应条件)