题目内容
(2011?朝阳区二模)下列说法不正确的是( )
分析:A.同温同压下,同体积,则气体的物质的量相同,气体的分子数相同以及利用1个CH4和CO2中含有的公用电子对数4;
B.根据铝跟盐酸或氢氧化钠溶液都能发生反应,利用反应的化学方程式确定铝与氢气的质量关系,进而进行分析判断即可;
C.根据Al3+能够发生水解;
D.根据质量换算成物质的量以及1个OH-和NH3所含的电子数都为10来计算.
B.根据铝跟盐酸或氢氧化钠溶液都能发生反应,利用反应的化学方程式确定铝与氢气的质量关系,进而进行分析判断即可;
C.根据Al3+能够发生水解;
D.根据质量换算成物质的量以及1个OH-和NH3所含的电子数都为10来计算.
解答:解:A.标准状况下,等体积的CH4和CO2的物质的量相同,1个CH4和CO2中含有的公用电子对数4,所以标准状况下,等体积的CH4和CO2所含的共用电子对数相等,故A正确;
B.铝与稀盐酸反应的化学方程式为:2Al+6HCl=2AlCl3+3H2↑;与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,由上述两个反应可知,参加反应的铝与生成的氢气的质量关系均为2Al~3H2,即与NaOH溶液、H2S04溶液反应产生等量的H2,所需铝粉的质量相等,故B正确;
C.Al3+能够发生水解,所以明矾溶液中K+的物质的量浓度大于Al3+的物质的量浓度,故C错误;
D.1mol OH-所含的电子数为10NA;17g NH3的物质的量为1mol,所以1molNH3所含的电子数为10NA,两者所含的电子数相等,故D正确;
故选C.
B.铝与稀盐酸反应的化学方程式为:2Al+6HCl=2AlCl3+3H2↑;与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,由上述两个反应可知,参加反应的铝与生成的氢气的质量关系均为2Al~3H2,即与NaOH溶液、H2S04溶液反应产生等量的H2,所需铝粉的质量相等,故B正确;
C.Al3+能够发生水解,所以明矾溶液中K+的物质的量浓度大于Al3+的物质的量浓度,故C错误;
D.1mol OH-所含的电子数为10NA;17g NH3的物质的量为1mol,所以1molNH3所含的电子数为10NA,两者所含的电子数相等,故D正确;
故选C.
点评:本题主要考查了物质的量的计算,掌握微粒内部粒子数目的计算是解题的关键,题目难度中等.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案
相关题目






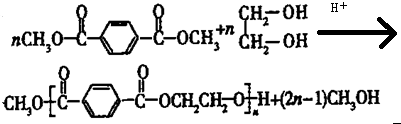
 合成
合成 的流程图.(注明反应条件)
的流程图.(注明反应条件)