题目内容
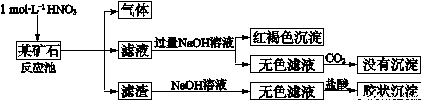
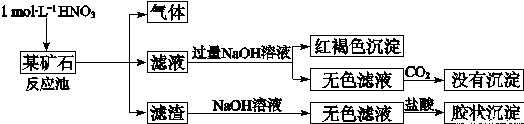
(12分)欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。
(1)Si在周期表中的位置是 。
(2)下列说法正确的是 。
| a.酸性:H2CO3>H2SiO3 | b.原子半径:O<C<Si<Al |
| c.稳定性:H2O>CH4>SiH4 | d.离子半径:O2-<Al3+ |
(3)该矿石的组成是 ,滤渣和NaOH溶液反应的离子方程式是 。
(4)该矿石和1 mol L-1HNO3反应的离子方程式 。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,目的是 ;若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1mol L-1 HNO3的体积为 L。
(12分)
(1)(1分)第三周期、ⅣA族
(2)(1分)abc
(3)(2分)FeCO3和SiO2 (2分)SiO2+2OH— = SiO32—+H2O
(4)(2分)3FeCO3+10H++NO3—= 3Fe3+ +3CO2↑+NO↑+5H2O
(5)(2分)NO循环使用能减少环境污染,NO跟H2O、O2反应后又得到硝酸提高原料利用率
(2分)3×104
解析:

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目