题目内容
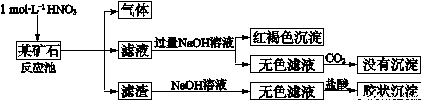
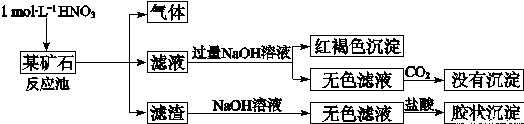
欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示.已知:碳酸不能溶解Al(OH)3沉淀.
(1)Si在周期表中的位置是
(2)下列说法正确的是
a.酸性:H2CO3>H2SiO3b.结合质子的能力:CO32->AlO2->HCO3-
c.稳定性:H2O>CH4>SiH4d.离子半径:O2-<Al3+
(3)该矿石的组成是
(4)该矿石和1mol?L-1 HNO3反应的离子方程式
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,目的是
分析:(1)根据硅的原子核外电子排布确定在周期表中的位置;
(2)a.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
b.对应的酸越强,则酸根离子得到质子的能力越弱;
c.元素的非金属性越强,对应的氢化物越稳定;
d.两种离子核外电子排布相同,核电荷数越大,离子半径越小;
(3)矿石加硝酸生成气体,可说明含有FeCO3,加入过量NaoH溶液后通入过量二氧化碳没有沉淀生成,说明没有Al2O3,滤渣溶解后加入盐酸生成胶状沉淀,说明含有SiO2;
(4)矿石含有FeCO3,可与HNO3反应;
(5)处理该矿石,逸出的气体为NO,可与氧气反应生成硝酸,可循环利用,结合反应的方程式计算.
(2)a.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
b.对应的酸越强,则酸根离子得到质子的能力越弱;
c.元素的非金属性越强,对应的氢化物越稳定;
d.两种离子核外电子排布相同,核电荷数越大,离子半径越小;
(3)矿石加硝酸生成气体,可说明含有FeCO3,加入过量NaoH溶液后通入过量二氧化碳没有沉淀生成,说明没有Al2O3,滤渣溶解后加入盐酸生成胶状沉淀,说明含有SiO2;
(4)矿石含有FeCO3,可与HNO3反应;
(5)处理该矿石,逸出的气体为NO,可与氧气反应生成硝酸,可循环利用,结合反应的方程式计算.
解答:解:(1)硅的原子核外有3个电子层,最外层电子数为4,则应位于周期表第三周期、ⅣA族,故答案为:第三周期、ⅣA族;
(2)a.非金属性:C>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故a正确;
b.酸性:H2CO3>HCO3->Al(OH)3,对应的酸越强,则酸根离子得到质子的能力越弱,则结合质子能力:AlO2->CO32->HCO3-,故b错误;
c.非金属性O>C>Si,元素的非金属性越强,对应的氢化物越稳定,故c正确;
d.两种离子核外电子排布相同,核电荷数越大,离子半径越小,则O2->Al3+,故d错误;
故答案为:ac;
(3)矿石加硝酸生成气体,可说明含有FeCO3,加入过量NaoH溶液后通入过量二氧化碳没有沉淀生成,说明没有Al2O3,滤渣溶解后加入盐酸生成胶状沉淀,说明含有SiO2,
滤渣和NaOH溶液反应的离子方程式是SiO2+2OH-=SiO32-+H2O,
故答案为:FeCO3和SiO2;SiO2+2OH-=SiO32-+H2O;
(4)矿石含有FeCO3,可与HNO3反应,离子方程式为3FeCO3+10H++NO3-=3Fe3++3CO2↑+NO↑+5H2O,
故答案为:3FeCO3+10H++NO3-=3Fe3++3CO2↑+NO↑+5H2O;
(5)由于NO是有毒气体,不能随意排放,所以这样做的目的是NO循环使用能减少环境污染,且NO跟H2O、O2反应后又得到硝酸提高原料利用率.根据以上分析可知,该矿石中含有碳酸亚铁和二氧化硅,其中碳酸亚铁的质量是2.36×103 kg-1.2×103 kg=1.16×103kg,物质的量是10000mol,则根据(4)中的方程式可知,消耗硝酸的物质的量是
mol,所以理论上至少需要1molL-1 HNO3的体积为3.0×104L.
故答案为:NO循环使用能减少环境污染,NO跟H2O、O2反应后又得到硝酸提高原料利用率;3×104.
(2)a.非金属性:C>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故a正确;
b.酸性:H2CO3>HCO3->Al(OH)3,对应的酸越强,则酸根离子得到质子的能力越弱,则结合质子能力:AlO2->CO32->HCO3-,故b错误;
c.非金属性O>C>Si,元素的非金属性越强,对应的氢化物越稳定,故c正确;
d.两种离子核外电子排布相同,核电荷数越大,离子半径越小,则O2->Al3+,故d错误;
故答案为:ac;
(3)矿石加硝酸生成气体,可说明含有FeCO3,加入过量NaoH溶液后通入过量二氧化碳没有沉淀生成,说明没有Al2O3,滤渣溶解后加入盐酸生成胶状沉淀,说明含有SiO2,
滤渣和NaOH溶液反应的离子方程式是SiO2+2OH-=SiO32-+H2O,
故答案为:FeCO3和SiO2;SiO2+2OH-=SiO32-+H2O;
(4)矿石含有FeCO3,可与HNO3反应,离子方程式为3FeCO3+10H++NO3-=3Fe3++3CO2↑+NO↑+5H2O,
故答案为:3FeCO3+10H++NO3-=3Fe3++3CO2↑+NO↑+5H2O;
(5)由于NO是有毒气体,不能随意排放,所以这样做的目的是NO循环使用能减少环境污染,且NO跟H2O、O2反应后又得到硝酸提高原料利用率.根据以上分析可知,该矿石中含有碳酸亚铁和二氧化硅,其中碳酸亚铁的质量是2.36×103 kg-1.2×103 kg=1.16×103kg,物质的量是10000mol,则根据(4)中的方程式可知,消耗硝酸的物质的量是
| 105 |
| 3 |
故答案为:NO循环使用能减少环境污染,NO跟H2O、O2反应后又得到硝酸提高原料利用率;3×104.
点评:该题综合考查粗硅的制备、元素周期律的应用、物质的检验、氧化还原反应方程式的书写、尾气处理和原料的使用以及有关计算,难度较大,注意必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目