题目内容
(18分)Ⅰ.如图所示为常见仪器的部分结构。
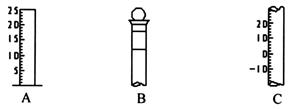
(1)请写出下列仪器的名称:A ,B ,C 。
(2)仪器B上标记有 (填序号)。
①质量 ②温度 ③刻度线 ④浓度 ⑤容积
(3)仪器B使用前必须 。
Ⅱ.现用98%的浓H2SO4(密度为1.84g/cm3)来配制480mL0.2mol/L的稀H2SO4。
有关操作为:①计算所需浓硫酸的体积 ②量取一定体积的浓硫酸 ③稀释、冷却 ④转移、洗涤 ⑤定容 ⑥摇匀
回答下列问题
(4)应量取的浓硫酸体积是 ,实验中所用的玻璃仪器除烧杯、玻璃棒、
量筒、胶头滴管外还有 ;
(5)第③步中稀释浓硫酸的操作是
(6)将所配制的稀H2SO4进行测定,发现实际浓度大于0.2mol/L。请你分析下列哪些操作会引起所配浓度偏大(填写字母) 。
E.烧杯未进行洗涤
F.在容量瓶中定容时俯视容量瓶刻度线
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。

(1)请写出下列仪器的名称:A ,B ,C 。
(2)仪器B上标记有 (填序号)。
①质量 ②温度 ③刻度线 ④浓度 ⑤容积
(3)仪器B使用前必须 。
Ⅱ.现用98%的浓H2SO4(密度为1.84g/cm3)来配制480mL0.2mol/L的稀H2SO4。
有关操作为:①计算所需浓硫酸的体积 ②量取一定体积的浓硫酸 ③稀释、冷却 ④转移、洗涤 ⑤定容 ⑥摇匀
回答下列问题
(4)应量取的浓硫酸体积是 ,实验中所用的玻璃仪器除烧杯、玻璃棒、
量筒、胶头滴管外还有 ;
(5)第③步中稀释浓硫酸的操作是
(6)将所配制的稀H2SO4进行测定,发现实际浓度大于0.2mol/L。请你分析下列哪些操作会引起所配浓度偏大(填写字母) 。
| A.用量筒量取浓硫酸时,仰视量筒的刻度 |
| B.容量瓶未干燥即用来配制溶液 |
| C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容 |
| D.往容量瓶转移时,有少量液体溅出 |
F.在容量瓶中定容时俯视容量瓶刻度线
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
(18分)
(1)A 量筒 ,B 容量瓶 ,C 温度计 。
(2) ②③⑤ (3) 检漏
(4) 5.4mL 500mL容量瓶
(5)将浓硫酸沿烧杯内壁慢慢加入水中,边加边用玻璃棒搅拌
(6) ACF
(1)A 量筒 ,B 容量瓶 ,C 温度计 。
(2) ②③⑤ (3) 检漏
(4) 5.4mL 500mL容量瓶
(5)将浓硫酸沿烧杯内壁慢慢加入水中,边加边用玻璃棒搅拌
(6) ACF
略

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目


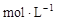 ,则第一次测出的盐酸的浓度偏高
,则第一次测出的盐酸的浓度偏高 玻璃棒、烧杯
玻璃棒、烧杯