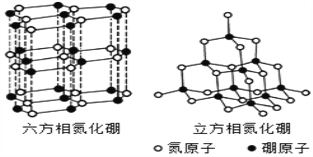
��Ŀ����
����Ŀ����֪����ԭ��HSO3��>I����������IO3��>I2���ں�3molNaHSO3����Һ����μ���KIO3��Һ������KIO3������I2�����ʵ����Ĺ�ϵ��������ͼ��ʾ������˵������ȷ����
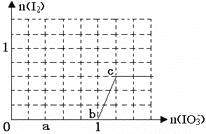
A. 0��a�䷢����Ӧ��3HSO3��+IO3��=3SO42-+I��+3H+
B. a��b�乲����NaHSO3�����ʵ���Ϊ1.8mol
C. b��c�䷴Ӧ��I2������������
D. ����Һ��I-��I2�����ʵ���֮��Ϊ5��3ʱ�������KIO3Ϊ1.1mol
���𰸡�C
��������
��ԭ��HSO-3>I-�����������Ƿ������·�Ӧ���ӷ���ʽ��IO3-+3HSO3-�TI-+3SO42-+3H+����������KIO3��������IO-3>I2������IO3-���Խ��H+����I-����I2�����ӷ���ʽ��IO3-+6H++5I-�T3H2O+3I2�����ݷ����ķ�Ӧ���жϸ�����IJ�����
��ԭ��HSO3>I�����������Ƿ������·�Ӧ���ӷ���ʽ��IO3+3HSO3�TI+3SO42+3H+����������KIO3��������IO3>I2������IO3���Խ��H+����I����I2�����ӷ���ʽ��IO3+6H++5I�T3H2O+3I2��
A.0a��û�еⵥ��������˵����������Ӻ�������������ӷ���������ԭ��Ӧ���ɵ��������������ص����ʵ�����1mol�����������Ƶ����ʵ�����3mol������������������������������������ת�Ƶ����غ�֪�����ɵ����������������ӷ���ʽΪ��IO3+3HSO3�TI+3SO42+3H+����A��ȷ��B.ab�����ص����ʵ�����0.6mol�����ݵ���غ����������ƵĹ�ϵʽ֪������NaHSO3�����ʵ���=0.6mol��3=1.8mol����B��ȷ��C. ����ͼ��֪��bc���ڷ���IO3+6H++5I�T3H2O+3I2��ֻ��IԪ�صĻ��ϼ۱仯������I2����������Ҳ�ǻ�ԭ�����C����D. ���ݷ�Ӧ2IO3-+6HSO3-�T2I-+6SO42-+6H+��3molNaHSO3����Һ����KIO3��Һ�����ʵ���Ϊ1mol�����ɵ����ӵ���Ϊ1mol�������ɵĵⵥ�ʵ����ʵ���Ϊxmol������ݷ�ӦIO3+6H++5I�T3H2O+3I2�����ĵ�KIO3�����ʵ���Ϊ(1/3)xmol�����ĵ����ӵ����ʵ���=(5/3)xmol��ʣ��ĵ����ӵ����ʵ���=(1(5/3)x)mol������Һ��n(I):n(I2)=5:3ʱ����![]() ��x=0.3mol������ԭ���غ�������ص����ʵ���=1mol+0.3mol��1/3=1.1mol����D��ȷ������ѡC��
��x=0.3mol������ԭ���غ�������ص����ʵ���=1mol+0.3mol��1/3=1.1mol����D��ȷ������ѡC��

 ����ȫ���ִʾ��ƪ��ϵ�д�
����ȫ���ִʾ��ƪ��ϵ�д� �����߿����ϵ�д�
�����߿����ϵ�д� �㾦�½̲�ȫ�ܽ��ϵ�д�
�㾦�½̲�ȫ�ܽ��ϵ�д�����Ŀ����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2�ǵ�ǰ��ѧ���о�����Ҫ���⡣
(1)��ѧ����H2��CO2�����״�ȼ�ϡ�Ϊ̽���÷�Ӧԭ������������ʵ�飺ij�¶��£����ݻ�Ϊ2 L���ܱ������г���1 mol CO2��3.25 mol H2�����¶�һ���������·�Ӧ�����CO2��CH3OH(g)��H2O(g)�����ʵ���(n)��ʱ��ı仯��ϵ��ͼ��ʾ��
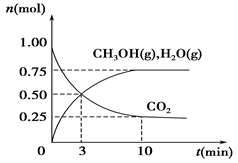
�ٴӷ�Ӧ��ʼ��3 minʱ��������ƽ����Ӧ����v(H2)��________��
�����д�ʩ��һ����ʹCO2��ת�����������________��
A����ԭ�������ٳ���1 mol CO2 B����ԭ�������ٳ���1 mol H2
C����ԭ�����г���1 mol He D��ʹ�ø���Ч�Ĵ���
E����С�������ݻ� F����ˮ��������ϵ�з����
����˵����Ӧ�Ѵ�ƽ��״̬����________(����ĸ,��ͬ)��
A.v(H2)=3v(CO2) B.������ѹǿ���ֲ���
C.v��(CO2)=v��(CH3OH) D.�������ܶȱ��ֲ���
(2)��ѧ�һ�����������һ���������������̼��Ӧ�����Ҵ�ȼ�ϣ����Ȼ�ѧ��Ӧ����ʽΪ2CO2(g)��6H2(g) ![]() CH3CH2OH(g)��3H2O(g)����H��a kJ��mol��1����һ��ѹǿ�£���ø÷�Ӧ��ʵ�����������ʾ������ݱ������ݻش��������⡣
CH3CH2OH(g)��3H2O(g)����H��a kJ��mol��1����һ��ѹǿ�£���ø÷�Ӧ��ʵ�����������ʾ������ݱ������ݻش��������⡣
n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
1.5 | 45 | 33 | 20 | 12 |
2 | 60 | 43 | 28 | 15 |
3 | 83 | 62 | 37 | 22 |
��������Ӧ��a________0(����ڡ���С�ڡ�)��
�ں����£���Ӧ��ϵ�м�������������Ӧ����������________(�������С�����䡱)��
������![]() ��ֵ���������Ҵ������ʵ���________(�������С�������䡱����ȷ����)��
��ֵ���������Ҵ������ʵ���________(�������С�������䡱����ȷ����)��