题目内容
X、Y、Z、W是短周期的四种元素,有关它们的信息如下表所示。
填写下列空白:(提示:不能用字母X、Y、Z、W作答)
(1)X有多种同素异形体,写出X2电子式是 ,
(2)X、Y、Z三种元素电负性由大到小顺序为_____。
(3)W元素原子基态时原子的电子排布式_________________。
(4)Z位于元素周期表第 周期第 族
(5)含W的一种硫酸盐是常用的净水剂,常温时该溶液的pH (填“=”、“>”或“<”),理由是: (用离子方程式表示)。
(6).25℃、101 kPa时,32 g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6 kJ的热量,写出该反应的热化学方程式 。
| 元素 | 部分结构知识 | 部分性质 |
| X | X原子核外电子占有9个原子轨道 | X的一种氧化物是形成酸雨的主要物质 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
填写下列空白:(提示:不能用字母X、Y、Z、W作答)
(1)X有多种同素异形体,写出X2电子式是 ,
(2)X、Y、Z三种元素电负性由大到小顺序为_____。
(3)W元素原子基态时原子的电子排布式_________________。
(4)Z位于元素周期表第 周期第 族
(5)含W的一种硫酸盐是常用的净水剂,常温时该溶液的pH (填“=”、“>”或“<”),理由是: (用离子方程式表示)。
(6).25℃、101 kPa时,32 g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6 kJ的热量,写出该反应的热化学方程式 。
(1) 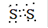 (2分)
(2分)
(2) Cl S C (2分)
(3)1S22S22P63S23P1(2分)
(4)三 ; ⅦA (各1分)
(5) ﹤ (1分) Al3++3H2O Al(OH)3(胶体)+3H+(2分)
Al(OH)3(胶体)+3H+(2分)
CH4(g)+2O2 (g)= CO2(g)+2H2O (l) ;△H =" -890.3" KJ·mol-1(3分)
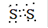 (2分)
(2分)(2) Cl S C (2分)
(3)1S22S22P63S23P1(2分)
(4)三 ; ⅦA (各1分)
(5) ﹤ (1分) Al3++3H2O
 Al(OH)3(胶体)+3H+(2分)
Al(OH)3(胶体)+3H+(2分)CH4(g)+2O2 (g)= CO2(g)+2H2O (l) ;△H =" -890.3" KJ·mol-1(3分)
试题分析:(1)X的氧化物是形成酸雨的主要物质,结合原子核外电子排布,可知X为S,S2类似于O2,原子间有两对电子。(2)由Y原子的结构可知其为C,由Z的化合价可判断其为Cl,所以电负性:Cl>S>C。(3)由最外层电子数等于2n-3可推知,W为Al。(5)A12(SO4)3为强酸弱碱盐,水解后溶液显酸性,Al3++3H2O
 Al(OH)3(胶体)+3H+。(6)Y最低价即结合H最多时,该物质为CH4,32 g CH4为2 mol,所以1 mol CH4放热-890.3kJ/mol。
Al(OH)3(胶体)+3H+。(6)Y最低价即结合H最多时,该物质为CH4,32 g CH4为2 mol,所以1 mol CH4放热-890.3kJ/mol。
练习册系列答案
相关题目