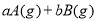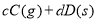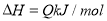题目内容
对于某一可逆反应,改变下列条件,一定能使化学平衡发生移动的是
A.增加某反应物的质量 B.使用催化剂
C.降低反应体系的压强 D.升高温度
D
【解析】
试题分析:A 只有增加的量能改变参加反应的物质的浓度,化学平衡才可能发生移动;B、使用催化剂,同等程度加快正逆反应速率,平衡不移动。 C.降低反应体系的压强,对反应前后气体体积不变的平衡,改变压强,平衡不移动;D.升高温度,平衡向吸热方向移动。所以答案D
考点:化学平衡的影响条件

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目