题目内容
【题目】下列说法不正确的是
A.离子化合物中的阳离子不一定是金属离子B.离子化合物中一定含有离子键
C.离子化合物中一定含有阳离子和阴离子D.离子化合物一定能导电
【答案】D
【解析】
A.离子化合物中的阳离子不一定是金属阳离子,如NH4Cl中阳离子为铵根,不是金属离子,故A正确;
B.含有离子键的化合物为离子化合物,故B正确;
C.阳离子和阴离子之间的静电作用称为离子键,所以离子化合物中一定含有阳离子和阴离子,故C正确;
D.固态离子化合物中的阴、阳离子不自由移动,不能导电,离子化合物一般溶于水或熔融状态能导电,故D错误;
故答案为D。

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
【题目】下表为元素周期表的一部分,回答下列有关问题(填写化学符号):
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ⑴ | ⑻ | ⑵ | |||||
三 | ⑶ | ⑷ | ⑸ | ⑹ | ⑺ | ⑼ | ||
四 | ⑽ | ⑾ | ⑿ |
(1)⑴-⑿元素的最高价氧化物对应的水化物中,酸性最强的是______,碱性最强的是_____。
(2)元素⑼在周期表中的位置_______________,若⑻的一种核素中含有10个中子,用![]() 表示该原子:______________。
表示该原子:______________。
(3)在⑴-⑿元素中,原子半径最小的是______________,原子半径最大的是__________。
(4)第三周期简单阴离子半径最大的离子是____________
【题目】已知: ①1mol晶体硅中含有2molSi-Si键。②Si(s)+O2(g)=SiO2(s)ΔH,其反应过程与能量变化如图所示。
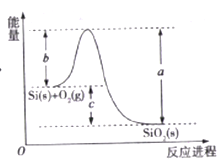
③
化学键 | Si-O | O=O | Si-Si |
断开1mol共价键所需能量/KJ | 460 | 500 | 176 |
下列说法正确的是
A. 晶体硅光伏发电是将化学能转化为电能的
B. 二氧化硅稳定性小于硅的稳定性
C. ΔH=-988 kJ/mol
D. ΔH=a-c
