题目内容
【题目】现有①CaCl2②金刚石③NH4Cl④Na2SO4⑤干冰⑥MgO⑦CH4⑧SiO2八种物质,按要求回答下列问题(填序号):
(1)属于原子晶体的化合物是_____,只有离子键的物质是_____。
(2)含有共价键的离子化合物是_____,晶体微粒以分子间作用力结合的是_____。
(3)①的电子式是_____,⑤的电子式是_____。
【答案】⑧ ![]()
![]()
![]()
![]()
![]()
【解析】
一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。含有离子键的化合物是离子化合物,原子间通过共价键形成的空间网状结构的晶体是原子晶体,分子间通过分子间作用力形成的晶体是分子晶体,据此解答。
①CaCl2中只有离子键,形成的是离子晶体;
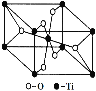
②金刚石中含有共价键,形成的是原子晶体;
③NH4Cl中含有离子键和极性键,形成的是离子晶体;
④Na2SO4中含有离子键和极性键,形成的是离子晶体;
⑤干冰中只有极性键,形成的是分子晶体;
⑥MgO中含有离子键,形成的是离子晶体;
⑦CH4中只有极性键,形成的是分子晶体;
⑧SiO2中只有极性键,形成的是原子晶体;
(1)综上所述属于原子晶体的化合物是⑧,只有离子键的物质是①⑥。
(2)含有共价键的离子化合物是③④,晶体微粒以分子间作用力结合的是⑤⑦。
(3)氯化钙中含有离子键,电子式是![]() ,二氧化碳中含有极性键,电子式是
,二氧化碳中含有极性键,电子式是![]() 。
。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目