题目内容
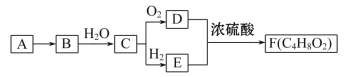
【题目】A、C、D、E、G、X、Y、Z是几种常见的短周期主族元素,其原子半径随原子序数变化如下图所示。已知C的最高正价与最低负价的绝对值相等;E的一种核素的质量数为18,中子数为10;G原子和Ne原子的核外电子数相差1;X的简单离子半径在同周期中最小;Y的单质是一种常见的半导体材料;Z的最外层有7个电子。回答下列问题:

(1)C在元素周期表中的位置_____,由A、E两种元素组成的18电子微粒的结构式为_________。
(2)E、G、Z三种元素的简单离子半径最小的是_____(填离子符号)。
(3)元素的非金属性:C_____Y(填“>”或“<”),其实验依据是_____(用离子方程式表示 )
(4)X的原子结构示意图为_____。
(5)Y与Z形成的化合物在一定条件下与足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是_____。
【答案】第二周期ⅣA族 H-O-O-H Na+ > SiO32-+H2O+CO2=H2SiO3↓+CO32-或SiO32-+2H2O+2CO2=H2SiO3↓+2HCO3- 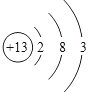 SiCl4+3H2O=H2SiO3↓+4HCl或SiCl4+4H2O=H4SiO4↓+4HCl
SiCl4+3H2O=H2SiO3↓+4HCl或SiCl4+4H2O=H4SiO4↓+4HCl
【解析】
A、C、D、E、G、X、Y、Z是几种常见的短周期主族元素,A的原子序数和原子半径均是最小的,则A是H。已知C的最高正价与最低负价的绝对值相等,位于第ⅣA,原子序数小于D和E,但原子半径大于D和E,则C是碳;E的一种核素的质量数为18,中子数为10,质子数是18-10=8,为O,则D是N;G原子和Ne原子的核外电子数相差1,原子半径最大,则G是Na;X的简单离子半径在同周期中最小,原子序数大于Na,则X是Al;Y的单质是一种常见的半导体材料,Y是Si;Z的最外层有7个电子,原子序数最大,则Z是Cl,据此解答。
根据以上分析可知A、C、D、E、G、X、Y、Z分别是H、C、N、O、Na、Al、Si、Cl。则
(1)碳元素在元素周期表中的位置第二周期第ⅣA族,由A、E两种元素组成的18电子微粒是双氧水,其结构式为H-O-O-H。
(2)核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则E、G、Z三种元素的简单离子半径最小的是Na+。
(3)同主族从上到下非金属性逐渐减弱,则元素的非金属性:C>Si,碳酸能制备硅酸可以说明,反应的离子方程式为SiO32-+H2O+CO2=H2SiO3↓+CO32-;
(4)X是Al,原子结构示意图为 。
。
(5)Y与Z形成的化合物在一定条件下与足量水反应,生成一种弱酸和一种强酸,根据原子守恒可知应该是硅酸和盐酸,则该反应的化学方程式是SiCl4+3H2O=H2SiO3↓+4HCl。

【题目】常温下,1mol化学键分解成气态原子所需要的能量用E表示,结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ·mol1) | 436 | 157 | 568 | 432 | 298 |
A. 表中最稳定的共价键是H-F
B. 1mol H2(g)与1mol F2(g)生成2molHF(g)放出25kJ的能量
C. 432kJ·mol1>E(H-Br)>298kJ·mol1
D. 1mol H2(g)分解成2mol H(g) 需吸收436kJ的能量