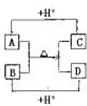
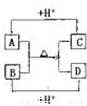
题目内容
| |||||||||||||||||||||||||||
答案:
解析:
解析:
(1) |
S,Na,Cl |
(2) |
|
(3) |
3,ⅠA |
(4) |
稳定性:H2S<HCl;酸性:H2SO4<HClO4 |
(5) |
2Al+2OH-+2H2O=2AlO2-+3H2↑ |
(6) |
答案:Al(OH)3+3H+=Al3++3H2O 分析:这是一条综合题,从各种途径确定元素是主要矛盾.元素确定后,其他问题都是水到渠成的事. 依题意,可推知X的最高正价=+6,负化合价=-2 |

练习册系列答案
相关题目

 (2009?巢湖二模)A、B、C、D四种常见粒子分别是由x、y、z三种元素中的两种构成,已知x、y、z均为短周期元素,且原子半径依次减小;A、B、C、D均含有相同数目的电子,其中A含有5个原子核,它们之间有如右图的转化关系:
(2009?巢湖二模)A、B、C、D四种常见粒子分别是由x、y、z三种元素中的两种构成,已知x、y、z均为短周期元素,且原子半径依次减小;A、B、C、D均含有相同数目的电子,其中A含有5个原子核,它们之间有如右图的转化关系: