题目内容
为确定某溶液的离子组成,分别进行如下实验:
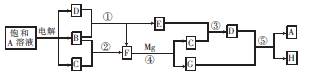
①测定溶液的pH,溶液显强碱性.
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体.
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
根据实验以下推测正确的是
- A.一定有SO32-离子
- B.一定有CO32-离子
- C.一定有Cl-离子存在
- D.不能确定HCO3-离子是否存在
B
分析:①说明溶液在含有氢根离子;
②现象说明有二氧化碳气体生成,无刺激性气味二氧化硫气体生成;
③说明产生钡离子的白色沉淀为碳酸钡;
④现象证明是氯离子的性质,但②步骤中加入了盐酸,不能说明原溶液中含氯离子;
解答:①测定溶液的pH,溶液显强碱性,说明溶液中含有氢氧根离子,碳酸氢根离子不能存在;
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体,说明生成的气体为二氧化碳,不是刺激性气味的二氧化硫,说明B原溶液中含碳酸根离子;
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.进一步证明溶液中含碳酸根离子;
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀说明含氯离子,但②步中加入盐酸含有氯离子,不能确定原溶液中含氯离子;
综上所述:溶液中一定含碳酸根离子,一定不含亚硫酸根离子碳酸氢根离子,氯离子不能确定.
故选B.
点评:本题考查了元素化合物性质,主要是离子性质的检验和应用,熟练撞我离子性质和特征反应,检验方法是解题关键.
分析:①说明溶液在含有氢根离子;
②现象说明有二氧化碳气体生成,无刺激性气味二氧化硫气体生成;
③说明产生钡离子的白色沉淀为碳酸钡;
④现象证明是氯离子的性质,但②步骤中加入了盐酸,不能说明原溶液中含氯离子;
解答:①测定溶液的pH,溶液显强碱性,说明溶液中含有氢氧根离子,碳酸氢根离子不能存在;
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体,说明生成的气体为二氧化碳,不是刺激性气味的二氧化硫,说明B原溶液中含碳酸根离子;
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.进一步证明溶液中含碳酸根离子;
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀说明含氯离子,但②步中加入盐酸含有氯离子,不能确定原溶液中含氯离子;
综上所述:溶液中一定含碳酸根离子,一定不含亚硫酸根离子碳酸氢根离子,氯离子不能确定.
故选B.
点评:本题考查了元素化合物性质,主要是离子性质的检验和应用,熟练撞我离子性质和特征反应,检验方法是解题关键.

练习册系列答案
相关题目
某溶液中含如下离子组中的若干种:K+、Mg2+、Fe3+、Fe2+、Cl-、CO32-、NO3-、SO42-、SiO32-、I-,某同学欲探究该溶液的组成,进行如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成
Ⅲ.取Ⅱ反应后的溶液分置于两支试管中,第一支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层出现紫红色
下列说法正确的是( )
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成
Ⅲ.取Ⅱ反应后的溶液分置于两支试管中,第一支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层出现紫红色
下列说法正确的是( )
| A、原溶液中肯定不含Fe2+、Mg2+、SiO32- | B、步骤Ⅱ中无色气体可能含有CO2,原溶液中可能含有CO32- | C、原溶液中肯定含有K+、Fe2+、NO3-、SO42-、I- | D、为确定是否含有Cl-,可取原溶液加入少量硝酸银和稀硝酸,观察是否产生沉淀 |