题目内容
【题目】某化学兴趣小组的同学利用如图所示实验装置进行实验(图中a、b、c表示止水夹). 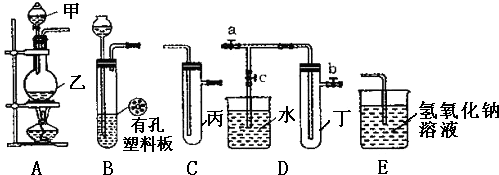
(1)甲、乙两仪器的名称是、
(2)利用B装置可制取的气体有(写出两种即可).
(3)A、C、E相连后的装置可用于制取Cl2 , 写出A中发生反应的化学方程式
(4)B、D、E装置相连后,在B中盛装浓硝酸和铜片(铜片放在有孔塑料板上),可制得NO2并进行有关实验.
①欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹 , 再打开止水夹 , 使烧杯中的水进入试管丁中.
②试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2 , 直至试管全部充满水,则所得溶液中溶质的物质的量浓度是 molL﹣1(保留2位有效数值,气体按标准状况计算).
【答案】
(1)分液漏斗;圆底烧瓶
(2)H2、NO、CO2、H2S等
(3)4HCl(浓)+MnO2 ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(4)a、b;c;0.045
【解析】解:(1)甲的名称为分液漏斗,乙的名称是圆底烧瓶,故答案为:分液漏斗、圆底烧瓶;
(2.)该装置的最大特点是可以控制反应的发生和停止,药品一般是固体和液体在常温下能反应,实验室用锌和稀硫酸制取氢气,Zn+H2SO4=ZnSO4+H2↑,锌难溶于水,氢气难溶于水,当将装置中的导气管关闭后,生成的H2使装置中的气压增大,从而使固体和液体分离,使反应停止,所以能用图中的装置制取氢气;金属铜能稀硝酸在常温下发生反应生成硝酸铜、一氧化氮和水,即3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,属于固体和液体混合反应不需要加热的反应,所以能用图中的装置制备,二氧化碳、硫化氢也是固体和液体不加热反应制备,CaCO3+2HCl=CaCl2+CO2↑+H2O,FeS+2HCl=FeCl2+H2S↑
故答案为:H2、NO、CO2、H2S等;
(3.)A、C、E相连后的装置可用于制取Cl2 , 装置A为发生装置是二氧化锰固体和浓盐酸加热反应生成氯气,反应的化学方程式为:4HCl(浓)+MnO2 ![]() MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O,
故答案为;4HCl(浓)+MnO2 ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(4.)①若二氧化氮能和水反应,则烧杯内气体的压强会减小,小于外界大气压,烧杯中的溶液会倒流于试管丁,所以先关闭止水夹 ab再打开止水夹 c,使烧杯中的水进入试管丁.
故答案为:ab;c;③设容器的体积为VL,所以二氧化氮气体的物质的量为n= ![]() ,二氧化氮和氧气、水反应生成硝酸,所以溶质是硝酸.
,二氧化氮和氧气、水反应生成硝酸,所以溶质是硝酸.
设生成硝酸的物质的量为xmol;
4NO2 | + | O2 | + | 2H2O | = | 4HNO3 |
4mol | 4mol | |||||
x= | xmol |
解得:x= ![]()
硝酸的物质的量浓度是C= ![]() =
= ![]() =0.045mol/L;故答案为:0.045.
=0.045mol/L;故答案为:0.045.
(1)依据装置图形状和用途分析仪器名称;(2)根据装置图可以看出,在不加热的条件下固体和液体反应制备气体,当将装置中的导气管关闭后,生成的气体使装置中的气压增大,从而使固体和液体分离,使反应停止,该装置具备随制随停的特点,据此即可解答;(3)A、C、E相连后的装置可用于制取Cl2 , 装置A为发生装置是二氧化锰固体和浓盐酸加热反应生成氯气,装置C是收集氯气,装置E是吸收剩余氯气;(4)①根据二氧化氮溶于水形成压强差分析;
②先根据二氧化氮的体积计算硝酸的物质的量,再根据C= ![]() 计算溶液的浓度.
计算溶液的浓度.

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】下表物质与其所含化学键类型、所属化合物类型完全正确的一组是
选 项 | A | B | C | D |
物 质 | CO2 | MgCl2 | HCl | NaOH |
所含化学键型 | 共价键 | 离子键、共价键 | 离子键 | 离子键、共价键 |
所属化合物型 | 共价化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
A. A B. B C. C D. D