题目内容
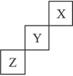
元素X、Y、Z在周期表中的相对位置如图所示:
已知Y元素原子的外围电子排布为ns(n-1)np(n+1),则下列说法不正确的是( )
| X | ||
| Y | ||
| Z |
| A.X元素所在周期中所含非金属元素最多 |
| B.Y元素在周期表的第3周期ⅥA族 |
| C.Y元素原子的外围电子排布为4s24p4 |
| D.Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3 |
Y元素原子的外围电子排布为ns(n-1)np(n+1),s能级最多容纳2个电子,故n-1=2,解得n=3,故Y元素原子的外围电子排布为3s23p4,Y为S元素,由X、Y、Z在周期表中的位置可知,X为F元素,Z为As元素,
A、X为F元素,处于第二周期,只有2两种金属元素,含有6种非金属元素,含非金属元素最多,故A正确;
B、Y为S元素,处于第三周期第ⅥA族,故B正确;
C、Y元素原子的外围电子排布为ns(n-1)np(n+1),s能级最多容纳2个电子,故n-1=2,解得n=3,故Y元素原子的外围电子排布为3s23p4,故C错误;
D、Z为As元素,是33号元素,核外电子排布式为1s22s22p63s23p63d104s24p3,故D正确;
故选C.
A、X为F元素,处于第二周期,只有2两种金属元素,含有6种非金属元素,含非金属元素最多,故A正确;
B、Y为S元素,处于第三周期第ⅥA族,故B正确;
C、Y元素原子的外围电子排布为ns(n-1)np(n+1),s能级最多容纳2个电子,故n-1=2,解得n=3,故Y元素原子的外围电子排布为3s23p4,故C错误;
D、Z为As元素,是33号元素,核外电子排布式为1s22s22p63s23p63d104s24p3,故D正确;
故选C.

练习册系列答案
相关题目
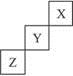 短周期元素X、Y、Z在周期中位置关系如图所示.
短周期元素X、Y、Z在周期中位置关系如图所示.

 _____________色的_____________体。该单质与铁粉反应的化学方程式为_____________________________________________________。
_____________色的_____________体。该单质与铁粉反应的化学方程式为_____________________________________________________。