题目内容
【题目】某种分子的球棍模型如下图所示(图中球与球之间的连线可代表单键、双键、叁键等):

不同形式的球代表不同的原子,对该物质的判断正确的是
A.①处的化学键是碳碳双键
B.②处的原子可能是氯原子
C.该分子中的原子不可能均在同一直线上
D.该分子不存在链状同分异构体
【答案】D
【解析】
试题分析:由于在碳链最左端的C原子上只结合了一个H原子,所以根据C原子最外层有四个电子,即碳四价的原则最左端1和2两个C原子间为碳碳叁键,依次类推该分子的结构简式为H—C≡C—C≡C—C≡C—C≡C—C≡N或H—C≡C—C≡C—C≡C—C≡C—C≡P,据此回答,A.根据上述推断,①处的化学键是碳碳叁键,A错误;B.根据上述推断,②处必须是叁键,而Cl只能形成单键,所以②处的原子不可能是氯原子,B错误;C. 因为在该分子中含有多个碳碳叁键,乙炔分子是直线型分子,所以这些原子均在同一直线上,不存在链状同分异构体,C错误,D正确;答案选D。

【题目】下列有关反应热的叙述中正确的是( )
①下表数据可以计算出 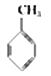 (g)+3H2(g)→
(g)+3H2(g)→ 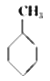 (g)的反应热;
(g)的反应热;
共价键 | C﹣C | C═C | C﹣H | H﹣H |
键能/(kJmol﹣1) | 348 | 610 | 413 | 436 |
②已知2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJmol﹣1, 则氢气的燃烧热为△H=﹣241.8kJmol﹣1
③由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
④X(g)+Y(g)═Z(g)+W(s)△H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
⑤由盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1molCO2固体时,放出的热量相等;
⑥25℃,101kPa时,1mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热.
A. ①②③④ B. ③④⑤ C. ④⑤ D. ⑥
【题目】下列实验操作或事实与预期实验目的或所得结论对应不正确的是
选项 | 实验操作或事实 | 实验目的或结论 |
A | 将滴有酚酞的氨水加热,红色逐渐变浅 | NH3·H2O受热分解,导致溶液碱性减弱 |
B | 在酒精灯上加热铝箔,铝箔熔化但不滴落 | Al2O3的熔点高于A1 |
C | 新收集的酸雨 | 酸雨中一定含有SO42- |
0 | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH | 确定碳和硅两元素非金属性 |
A. A B. B C. C D. D
