题目内容
已知电子工业上常用FeCl3溶液来溶解电路板中的铜。某一反应体系有反应物和生成物共三种物质:FeCl3、FeCl2、Fe 。完成下列问题:
(1)该反应中的还原产物的化学式是 ,氧化产物的化学式是 。
(2)该反应中,发生还原反应的过程是(填化学式) → 。
(3)该反应的离子方程式为: 。
(4)标出该反应电子转移的方向和数目
(5)如反应转移了0.3mol电子,则 (填“溶解”或“生成”)的铁的质量为 。
【答案】
(1)Fe Cl2;FeCl2;(各1分)
(2)FeCl3;FeCl2。(各1分)
(3)2Fe3++Fe=3Fe2+(2分)。
(4)
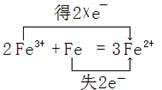 用单线桥表示也可(2分)
用单线桥表示也可(2分)
(5)溶解(2分);8.4。(2分)
【解析】略

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目


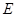 可以发生反应:2E+I
可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.