题目内容
在通常条件下,下列各组物质的性质排列顺序正确的是( )
| A、热稳定性:HF>H2O>NH3 | B、水溶性:HCl>NH3>SO2 | C、金属的原子化热:Al<Mg<Na | D、熔点:CO2>KCl>SiO2 |
分析:A.非金属性越强,氢化物的稳定性越强;
B.氨气溶解性大于氯化氢;
C.原子化热是用来衡量金属键强弱的物理量,指将1摩尔金属转变成气态原子所需的最小能量;金属原子化热数值小时,其熔点低,质地软,反之则熔点高,硬度小;
D.二氧化硅为原子晶体,氯化钾为离子晶体,二氧化碳固体为分子晶体,据此判断它们的熔点.
B.氨气溶解性大于氯化氢;
C.原子化热是用来衡量金属键强弱的物理量,指将1摩尔金属转变成气态原子所需的最小能量;金属原子化热数值小时,其熔点低,质地软,反之则熔点高,硬度小;
D.二氧化硅为原子晶体,氯化钾为离子晶体,二氧化碳固体为分子晶体,据此判断它们的熔点.
解答:解:A.非金属性大小为:F>O>N,则氢化物稳定性大小为:HF>H2O>NH3,故A正确;
B.常温下,1体积水中能够分别溶解700体积氨气、500体积氯化氢、40体积二氧化碳,所以它们的溶解性大小关系为:NH3>HCl>SO2,故B错误;
C.根据金属镁、铝和钠的熔点可知,金属的原子化热最大的为铝,其次为镁,最小的为钠,正确关系为:Al>Mg>Na,故C错误;
D.二氧化硅为原子晶体,氯化钾为离子晶体,二氧化碳固体为分子晶体,则三者的熔点大小为:CO2<KCl<SiO2,故D错误;
故选A.
B.常温下,1体积水中能够分别溶解700体积氨气、500体积氯化氢、40体积二氧化碳,所以它们的溶解性大小关系为:NH3>HCl>SO2,故B错误;
C.根据金属镁、铝和钠的熔点可知,金属的原子化热最大的为铝,其次为镁,最小的为钠,正确关系为:Al>Mg>Na,故C错误;
D.二氧化硅为原子晶体,氯化钾为离子晶体,二氧化碳固体为分子晶体,则三者的熔点大小为:CO2<KCl<SiO2,故D错误;
故选A.
点评:本题考查了元素周期律的应用、晶体熔沸点比较等知识,题目难度不大,注意掌握元素周期律内容,能够根据元素周期律判断元素非金属性强弱,明确晶体类型与熔沸点大小关系.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
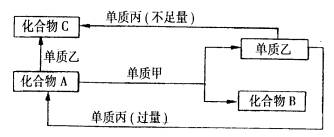
 A、B、C是中学化学中常见的无机物,且各由两种元素组成;甲、乙、丙是三种常见的单质;这些化合物和单质间存在如图所示转化关系(这些转化关系都不需要使用催化剂),回答下列问题:
A、B、C是中学化学中常见的无机物,且各由两种元素组成;甲、乙、丙是三种常见的单质;这些化合物和单质间存在如图所示转化关系(这些转化关系都不需要使用催化剂),回答下列问题:
 (2012?琼海一模)已知A为中学化学中的一种盐,B、C为日常生活中常见的金属.通常条件下D、G为无色无味气体.已知用惰性电极电解A溶液一段时间后,产物只有C、D和E的稀溶液.各物质之间的转化关系如图(部分反应产物已略去).
(2012?琼海一模)已知A为中学化学中的一种盐,B、C为日常生活中常见的金属.通常条件下D、G为无色无味气体.已知用惰性电极电解A溶液一段时间后,产物只有C、D和E的稀溶液.各物质之间的转化关系如图(部分反应产物已略去).