题目内容
【题目】下表标出的是元素周期表的一部分元素,用元素符号回答下列问题:
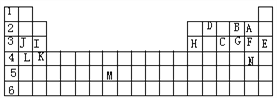
(1)表中用字母标出的14种元素中,化学性质最不活泼的是________,主族元素中金属性最强的是____,非金属性最强是 __,常温下单质为液态的非金属元素是______;M所在的族是______。
(2)C气态氢化物的化学式分别为____,A、B、C的氢化物中最稳定的是_______。
(3)第三周期中原子半径最小的是________________。
【答案】 Ar K F Br ⅦB PH3 HF Cl
【解析】表中14种元素按字母顺序分别是F、O、P、C、Ar、Cl、S、Al、Mg、Na、Ca、K、Tc、Br。
(1). 表中用字母标出的14种元素中,化学性质最不活泼的是稀有气体Ar,主族元素中金属性最强的是碱金属元素K,非金属性最强是F,常温下单质为液态的非金属元素只有一种,就是Br;元素周期表有18列分成16个族,从左到右依次是IA、IIA、IIIB、IVB、VB、VIB、VIIB等等,M位于第7列,所以它所在的族是ⅦB。
(2). C气态氢化物的化学式分别为PH3,F、O、P的氢化物中最稳定的是HF。
(3). 同一周期元素从左到右原子半径依次减小,所以第三周期中原子半径最小的是Cl(稀有气体的原子半径测定方法与主族元素不同,所以不参与比较。)。

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目




