题目内容
【题目】一种新型乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍。电池总反应为:C2H5OH +3O2= 2CO2 +3H2O,电池示意图如下图。下面对这种电池的说法正确的是:
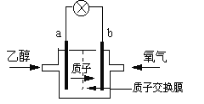
A. 标准状况下,通入5.6LO2并完全反应后,有0.5mol电子转移
B. 电池工作时电子由b极沿导线经灯泡再到a极
C. 电池正极的电极反应为:4H+ +O2 +4e- =2H2O
D. b极为电池的负极
【答案】C
【解析】
A. 标准状况下,5.6LO2的物质的量为![]() =0.25mol,完全反应后,有0.25mol×4=1mol电子转移,故A错误;B.电池工作时,电子从负极流向正极,在该电池中由a极流向b极,故B错误;C.在燃料电池中,正极上发生氧气得电子的还原反应,在酸性电解质环境下,正极的电极反应为:4H++O2+4e-=2H2O,故C正确;D.在燃料电池中,燃料乙醇在负极发生失电子的反应,氧气是在正极上发生得电子的反应,则a为负极,故D错误;故选C。
=0.25mol,完全反应后,有0.25mol×4=1mol电子转移,故A错误;B.电池工作时,电子从负极流向正极,在该电池中由a极流向b极,故B错误;C.在燃料电池中,正极上发生氧气得电子的还原反应,在酸性电解质环境下,正极的电极反应为:4H++O2+4e-=2H2O,故C正确;D.在燃料电池中,燃料乙醇在负极发生失电子的反应,氧气是在正极上发生得电子的反应,则a为负极,故D错误;故选C。

练习册系列答案
 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目