题目内容
1)配平氧化还原反应方程式:
__ C2O42-+__MnO4-+__H+= __CO2+__Mn2++__H2O
(2)称取6.0 g含H2C2O4·2H2O、KOH、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为___mol。
②第二份溶液中滴加0.12mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由__变为__。该溶液中还原剂的物质的量为___mol。
③原试样中H2C2O4·2H2O的质量分数为___。KHC2O4的质量分数为___。
【答案】(1)5 2 16 12 2 8
(2)①0.005;②无色;紫红色;0.004。 ③21%;64%。
【解析】(1)C:+3→+4,改变量(4-3)×2=2,Mn:+7→+2,改变量(7-2)×1=5,根据化合价升降总数相等,所以在C2O42-前配5,MnO4-前配2,根据C和Mn原子守恒,分别在CO2和Mn2+前配12和2,再由电荷守恒在H+前配16,最后根据离子方程式两边的H个数相等在水前面配8,经检验离子方程式两边的氧原子相等。
(2)①由H++OH- ===H2O知,n(H+)=n(OH-)=0.25mol·L-1×0.02L=0.005mol。
②原溶液无色,而KMnO4为紫红色,所以当溶液中的H2C2O4和KHC2O4反应完全时,溶液呈紫红色。
由电子守恒得:n(还)×2=0.1mol·L-1×0.016L×5,n(还)=0.004mol。
③由于实验时所取溶液均为配置时的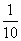 ,所以①、②中计算的数据均为配置溶液中溶质的
,所以①、②中计算的数据均为配置溶液中溶质的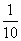 ,由①得:2n(H2C2O4·2H2O)+n(KHC2O4)=0.05mol,由②得:n(H2C2O4·2H2O)+n(KHC2O4)=0.04mol,解上述两个方程式得:n(H2C2O4·2H2O)=0.01mol,n(KHC2O4)=0.03mol,H2C2O4·2H2O的质量分数为:
,由①得:2n(H2C2O4·2H2O)+n(KHC2O4)=0.05mol,由②得:n(H2C2O4·2H2O)+n(KHC2O4)=0.04mol,解上述两个方程式得:n(H2C2O4·2H2O)=0.01mol,n(KHC2O4)=0.03mol,H2C2O4·2H2O的质量分数为: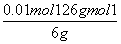 ×120%=21%,KHC2O4的质量分数为:
×120%=21%,KHC2O4的质量分数为: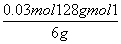 ×120%=64%。
×120%=64%。
【考点分析】将酸碱中和滴定的知识迁移到氧化还原反应中。

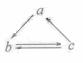 下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
| a | b | c | |
| A | Al | AlCl3 | Al(OH)3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | CH2=CH2 | CH3CH2OH | CH3CHO |
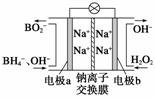 ⑴据报道以硼氢化合物NaBH4(B为+3价)和H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt或C,正极材料采用MnO2,其工作原理如右图所示。该电池放电时正极的电极反应式为_________________________;以MnO2作正极材料,可能是因为_____________________________。
⑴据报道以硼氢化合物NaBH4(B为+3价)和H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt或C,正极材料采用MnO2,其工作原理如右图所示。该电池放电时正极的电极反应式为_________________________;以MnO2作正极材料,可能是因为_____________________________。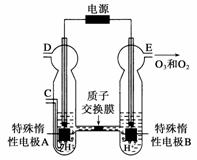 H2O2(l)===H2O(l)+
H2O2(l)===H2O(l)+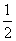 O2(g),ΔH=-98 kJ·mol-1
O2(g),ΔH=-98 kJ·mol-1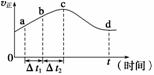 ⑷新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+O3(g)
⑷新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+O3(g) NO2(g)+O2(g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间
NO2(g)+O2(g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间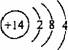
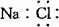 A.氯化钠的电子式: B.乙烯的结构简式:C2H4
A.氯化钠的电子式: B.乙烯的结构简式:C2H4  2SO3(g),△H=—197KJ/mol,同温下,往体积相同的密闭容器A、B中分别充入2molSO2、1mol O2和1mol SO2、0.5mol O2,当它们分别达到平衡时放出的热量为Q1KJ和Q2 KJ,则下列比较正确的是( )
2SO3(g),△H=—197KJ/mol,同温下,往体积相同的密闭容器A、B中分别充入2molSO2、1mol O2和1mol SO2、0.5mol O2,当它们分别达到平衡时放出的热量为Q1KJ和Q2 KJ,则下列比较正确的是( )