题目内容
11.将1.76g铜镁合金完全溶解于50mL密度为1.40g•mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1344mL(标准状况),向反应后的溶液中加入1.0mo1•L-1NaOH溶液,当金属离子全部沉淀时,得到3.12g沉淀.下列说法不正确的是(写出过程)( )| A. | 该合金中铜与镁的物质的量之比是1:1 | |
| B. | 该浓硝酸中HN03的物质的量浓度是14.0mo1•L-1 | |
| C. | NO2和N2O4的混合气体中,NO2的体积分数是80% | |
| D. | 得到3.12g沉淀时,加入NaOH溶液的体积是620mL |
分析 A.金属离子全部沉淀时,得到3.12g沉淀为氢氧化铜、氢氧化镁,故沉淀中氢氧根的质量为3.12g-1.76g=1.36g,氢氧根的物质的量为$\frac{1.36g}{17g/mol}$=0.08mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,令铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,根据提供的电子物质的量与二者质量之和列方程计算x、y的值,据此解答;
B.根据c=$\frac{1000ρω}{M}$计算该浓硝酸的物质的量浓度;
C.根据n=$\frac{V}{{V}_{m}}$计算NO2和N2O4混合气体的物质的量,令二氧化氮的物质的量为amol,根据电子转移列方程计算;
D.反应后溶质为硝酸钠,根据氮元素守恒计算硝酸钠的物质的量,根据钠离子守恒可知n(NaOH)=n(NaNO3),再根据V=$\frac{n}{c}$计算需要氢氧化钠溶液的体积.
解答 解:A.金属离子全部沉淀时,得到3.12g沉淀为氢氧化铜、氢氧化镁,故沉淀中氢氧根的质量为3.12g-1.76g=1.36g,氢氧根的物质的量为$\frac{1.36g}{17g/mol}$=0.08mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,令铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:$\left\{\begin{array}{l}{2x+2y=0.08}\\{64x+24y=1.76}\end{array}\right.$,解得x=0.02,y=0.02,故合金中铜与镁的物质的量之比是0.02mol:0.02mol=1:1,故A正确;
B.该浓硝酸密度为1.40g/mL、质量分数为63%,故该浓硝酸的物质的量浓度为$\frac{1000×1.4×63%}{63}$mol/L=14mol/L,故B正确;
C.NO2和N2O4混合气体的物质的量为$\frac{1.344L}{22.4L/mol}$=0.06mol,令二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.06-a)mol,根据电子转移守恒可知,a×1+(0.06-a)×2×1=0.08,解得a=0.04,故NO2的体积分数是$\frac{0.04mol}{0.06mol}$×100%=66.7%,故C错误;
D.根据钠离子守恒可知,氢氧化钠的物质的量等于反应后溶液中硝酸钠的物质的量,根据氮元素守恒可知,硝酸钠的物质的量为0.05L×14mol/L-0.04mol-(0.06-0.04)×2=0.62mol,故需要氢氧化钠溶液的体积为$\frac{0.62mol}{1mol/L}$=0.62L=620mL,故D正确,
故选:C.
点评 本题考查混合物的有关计算,难度中等,理解反应发生的过程是关键,是对学生综合能力的考查,注意根据守恒思想进行的解答.

 名校课堂系列答案
名校课堂系列答案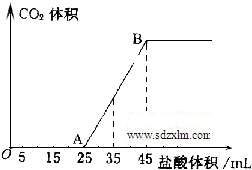 某实验小组配制0.10mol/L NaOH溶液并进行有关性质实验,回答下列问题.
某实验小组配制0.10mol/L NaOH溶液并进行有关性质实验,回答下列问题.(1)若实验中大约要使用475mL NaOH溶液,至少需要称量NaOH固体2.0g.
(2)从图中选择称量NaOH固体所需要的仪器是(填字母)abe.
| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
①称量时,左盘高,右盘低
②固体溶解后未冷却到室温就直接转移到容量瓶中
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度实验室欲配制
(4)向VmL上述浓度的NaOH溶液中,通入一定量的CO2后,然后向该溶液中逐滴加入1mol.L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如图所示:
①当加入35.0mL盐酸溶液时,产生标准状况下二氧化碳的体积为224mL;
②计算所取氢氧化钠溶液的体积V=450mL.
(5)取上述氢氧化钠溶液200mL,加入适量铝粉使之恰好完全反应,该反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,逐渐向反应后的溶液中至少加入1.0mol.L-1的盐酸80 mL才能使生成的沉淀完全溶解.
| A. | 8.00g | B. | 16.0g | C. | 25.0g | D. | 12.5g |
| A. | 树立“同呼吸、共奋斗”的行为推测,倡导节约、绿色消费方式和生活习惯 | |
| B. | 用浸泡过的高锰酸钾的硅藻土来吸收香蕉产生的乙烯,达到保鲜的目的 | |
| C. | 手机外壳上贴的碳纤维外膜是一种新型有机高分子材料 | |
| D. | 雾霾天气的形成与机动车辆猛增和尾气超标有关 |
| A. | 11 | B. | 22 | C. | 44 | D. | 77 |
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | Na2CO3 | H2SO4 | NaOH | SO2 | CO2 |
| B | NaOH | HCl | NaCl | Na2O | CO2 |
| C | NaOH | CH3COOH | CaF2 | CO | SO2 |
| D | KOH | HNO3 | CaCO3 | CaO | SO2 |
 )、乙醛(CH3CHO)、乙酸(CH3COOH)、乙醇(CH3CH2OH).
)、乙醛(CH3CHO)、乙酸(CH3COOH)、乙醇(CH3CH2OH). 某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析: 2Z
2Z