题目内容
【题目】通过实验探究发现化学反应中的某种规律,再寻求理论上的科学合理解释,是化学工作者的重要研究方法。
I.在体积可变的密闭容器中投入1 mol CO和2molH2,不同条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图所示。
CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图所示。

(1)M点H2的转化率为___________;反应速率N点v正(CO)___________M点ν逆(CO)(填“>”“<”或“=”)
(2)若M点对应混合气体的体积为1L,则506K时,该反应平衡常数K=___________(保留三位小数)。图表示平衡常数的对数(lgK)与温度的关系,B、C点中能正确表示该反应的lgK与T的关系的点为___________。

(3)在2L恒容密闭容器中充入 a mol H2、2 mol CO和7.4 mol CH3OH(g),在506K下进行上述反应。为了使该反应逆向进行,a的取值范围为___________。
Ⅱ.砷及其化合物有着广泛的用途。砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。已知H3AsO4的pKa1、pKa2、pKa3依次为2.25、6.77、11.40(已知:pKa=-lgKa)。
回答下列问题:
(4)NaH2AsO4溶液呈___________(填酸性”、“中性”或“碱性”),试通过计算说明___________。
(5)某小组同学欲探究可逆反应AsO33-+I2+2OH-![]() AsO43-+2I-+H2O,设计如图所示装置。加入试剂并连接裝置,电流由C2流入C1。当电流变为零时,向装置左边烧杯中逐滴加入一定量2 mol/L HCl,发现又产生电流,实验中电流与时间的关系如图所示。
AsO43-+2I-+H2O,设计如图所示装置。加入试剂并连接裝置,电流由C2流入C1。当电流变为零时,向装置左边烧杯中逐滴加入一定量2 mol/L HCl,发现又产生电流,实验中电流与时间的关系如图所示。

写出图4中c点对应的正极反应式___________,能判断该反应达到平衡状态的是___________。
a.2v(I-)正=v(AsO33-)逆 b.溶液pH不再变化
c.电流表示数变为零 d.右边烧杯中c(K+)不变
【答案】25% < 0.148 B a<10 酸性 Kh3=![]() =
=![]() =10-11.75<10-6.77即Ka2>Kh3,溶液呈酸 AsO43-+2e-+2H+=AsO32-+H2O bc
=10-11.75<10-6.77即Ka2>Kh3,溶液呈酸 AsO43-+2e-+2H+=AsO32-+H2O bc
【解析】
(1)根据图像可知,M点时,生成的甲醇为0.25mol,则反应的H2为0.5mol,H2的转化率=0.5mol/2mol×100%=25%;其他条件相同时,压强越大,反应速率越快,反应速率:N点v正(CO)<M点ν逆(CO)。
(2)平衡时消耗氢气是0.5mol,剩余CO和氢气分别是0.75mol、1.5mol,溶剂为1L,所以506K时该反应的平衡常数K=0.25/(0.75×1.52)=0.148;正反应放热,升高温度平衡向逆反应方向进行,平衡常数减小,lgK减小,所以能正确表示该反应的lgK与温度(T)的关系点为B。
(3)起始浓度c(CO)=1mol/L,c(H2)=0.5amol/L,c(CH3OH)=3.7mol/L,浓度熵Qc=![]() ,为了是该反应逆向进行,要求Qc>K,即
,为了是该反应逆向进行,要求Qc>K,即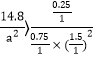 ,a的范围为a<10。
,a的范围为a<10。
(4)NaH2AsO4溶液呈酸性,Kh3=![]() =
=![]() =10-11.75<10-6.77即Ka2>Kh3,溶液呈酸性。
=10-11.75<10-6.77即Ka2>Kh3,溶液呈酸性。
(5)图4中c点酸性条件下对应图3装置的正极AsO43-得电子产生AsO33-,电极反应式为AsO43-+2e-+2H+=AsO32-+H2O。a.根据速率关系,v(I-)正=2v(AsO33-)逆,则等式始终成立,反应不一定处于平衡状态;b.溶液的pH不再变化,则氢氧根离子浓度也保持不变,反应处于平衡状态;c.电流表示数变为零则氧化还原反应中电子转移不再增减,反应物的浓度保持不变,反应处于平衡状态;d.右边烧中K+没有参与反应,则c(K+)始终不变,反应不一定处于平衡状态,答案选bc。
(1)根据图像可知,M点时,生成的甲醇为0.25mol,则反应的H2为0.5mol,H2的转化率=0.5mol/2mol×100%=25%;其他条件相同时,压强越大,反应速率越快,反应速率:N点v正(CO)<M点ν逆(CO)。本小题答案为:25% ;< 。
(2)平衡时消耗氢气是0.5mol,剩余CO和氢气分别是0.75mol、1.5mol,溶剂为1L,所以506K时该反应的平衡常数K=0.25/(0.75×1.52)=0.148;正反应放热,升高温度平衡向逆反应方向进行,平衡常数减小,lgK减小,所以能正确表示该反应的lgK与温度(T)的关系点为B。本小题答案为:0.148;B。
(3)起始浓度c(CO)=1mol/L,c(H2)=0.5amol/L,c(CH3OH)=3.7mol/L,浓度熵Qc=![]() ,为了是该反应逆向进行,要求Qc>K,即
,为了是该反应逆向进行,要求Qc>K,即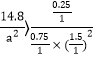 ,a的范围为a<10。本小题答案为:a<10。
,a的范围为a<10。本小题答案为:a<10。
(4)NaH2AsO4溶液呈酸性,Kh3=![]() =
=![]() =10-11.75<10-6.77即Ka2>Kh3,溶液呈酸性。本小题答案为:酸性;Kh3=
=10-11.75<10-6.77即Ka2>Kh3,溶液呈酸性。本小题答案为:酸性;Kh3=![]() =
=![]() =10-11.75<10-6.77即Ka2>Kh3,溶液呈酸性。
=10-11.75<10-6.77即Ka2>Kh3,溶液呈酸性。
(5)图4中c点酸性条件下对应图3装置的正极AsO43-得电子产生AsO33-,电极反应式为AsO43-+2e-+2H+=AsO32-+H2O。a.根据速率关系,v(I-)正=2v(AsO33-)逆,则等式始终成立,反应不一定处于平衡状态;b.溶液的pH不再变化,则氢氧根离子浓度也保持不变,反应处于平衡状态;c.电流表示数变为零则氧化还原反应中电子转移不再增减,反应物的浓度保持不变,反应处于平衡状态;d.右边烧中K+没有参与反应,则c(K+)始终不变,反应不一定处于平衡状态,答案选bc。本小题答案为:AsO43-+2e-+2H+=AsO32-+H2O;bc。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案







